两种蛋白的原核表达与性能研究毕业论文
2020-02-19 14:35:13
摘 要
由于原核系统表达重组蛋白的方法比较简单,可以表达的蛋白种类也比较多,与真核表达系统相比培养成本较为低廉,多数基因克隆和表达实验都首选在原核表达系统中进行。大肠杆菌表达系统是最常用的原核表达系统,该菌种成本低,生长繁殖快,操作简单且易得到大量产物,因此常常用于重组蛋白的生产。
本实验选用的两种蛋白分别为来自真核生物的磁受体蛋白MagR和来自原核生物的AidH内酯酶。磁受体蛋白MagR是一种非常具有潜力的融合蛋白标签,它能够与磁性纳米粒子(Fe3O4)结合从而实现酶的固定化,而AidH内酯酶能有效地降解群体感应信号分子从而抑制群体感应效应。本实验通过构建融合蛋白AidH-MagR实现两种蛋白的原核表达,进一步证明了原核表达系统在科学探索与实践中的优势。
为了提高酶的利用率和稳定性,本实验利用磁性蛋白MagR实现酶的固定化,首先对AidH基因与MagR基因进行分子克隆,然后表达和纯化目的蛋白,同时绘制了生长曲线,最后探究了该蛋白的最适合表达条件,实验中所获得的实验数据将为进一步应用于医学免疫及耐药分析奠定基础。群体感应信号分子可能成为生物技术防治动植物细菌病害的新的突破口,这为防治细菌侵染提供了一条可行的途径,本实验丰富了AidH内酯酶抑菌作用的研究内容,不仅具有重要的理论意义,更具有深刻的现实意义。
关键词:群体感应淬灭酶,生物防治,MagR磁性蛋白,AidH内酯酶
Abstract
The method for expressing recombinant protein in the prokaryotic system is relatively simple, and the number of proteins that can be expressed is also relatively large. Compared with the eukaryotic expression system, the culture cost is relatively low, so most gene cloning and expression experiments are preferred in the prokaryotic expression system. The E. coli expression system is the most common prokaryotic expression system, which is often used for the production of recombinant proteins because of its low cost, rapid growth and reproduction, simple operation and easy access to a large number of products.
The two proteins selected in this experiment are the magnetic receptor protein MagR from eukaryotes and the AidH lactonase from prokaryotes. The magnetic receptor protein MagR is a highly potential fusion protein tag which can combine with magnetic nanoparticles (Fe3O4) to immobilize the enzyme, and AidH lactonase effectively inhibit quorum sensing effect by degrades quorum sensing molecules. In this experiment, the prokaryotic expression of the two proteins was realized by constructing the fusion protein AidH-MagR, which further proved the advantages of the prokaryotic expression system in scientific exploration and practice.
In order to improve the utilization and stability of the enzyme, the immobilization of the enzyme was carried out by using the magnetic protein MagR. First, gene aidH and magR will be cloned, then the target protein will be expressed and purified. At the same time, the growth curve will be drawn. Finally, we will explore the most suitable expression conditions for the protein. The experimental data in the experiment will lay the foundation for further application in medical immunity and drug resistance analysis. The quorum sensing signal molecule might become a new breakthrough for biotechnologically prevent the animals’ and plants’ bacterial disease, which provides a feasible way to prevent bacterial infection. This experiment enriches the research content of the bacteriostasis of AidH lactonase, which not only has important theoretical significance, but also has profound practical significance.
Key Words:quorum sensing quenching enzyme; biological prevention; magnetic protein MagR; AidH lactonase
目 录
摘 要 I
Abstract II
1.绪论 1
1.1 重组蛋白的原核表达和真核表达 1
1.1.1重组蛋白的构建 1
1.1.2真核表达系统 1
1.1.3原核表达系统 2
1.2 大肠杆菌pET系统表达重组蛋白 3
1.3 AidH蛋白 4
1.3.1群体感应效应和群体感应信号分子 4
1.3.2 群体感应信号淬灭酶功能 5
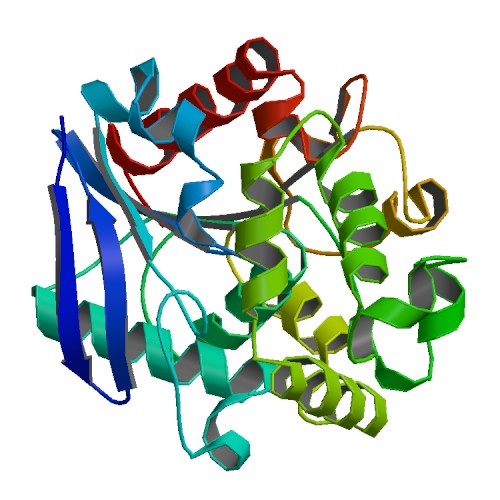
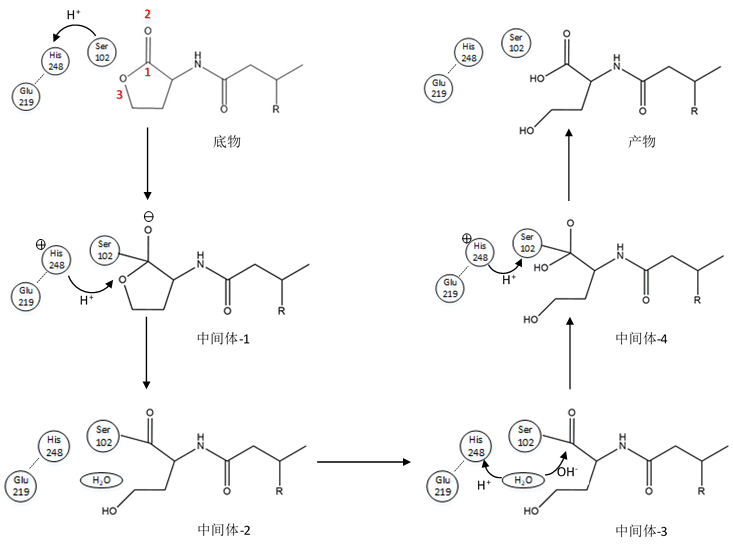
1.3.3 N-乙酰高丝氨酸内酯酶AidH的结构及作用机制 6
1.3.4 AidH内酯酶的应用前景及问题 8
1.4 MagR蛋白 9
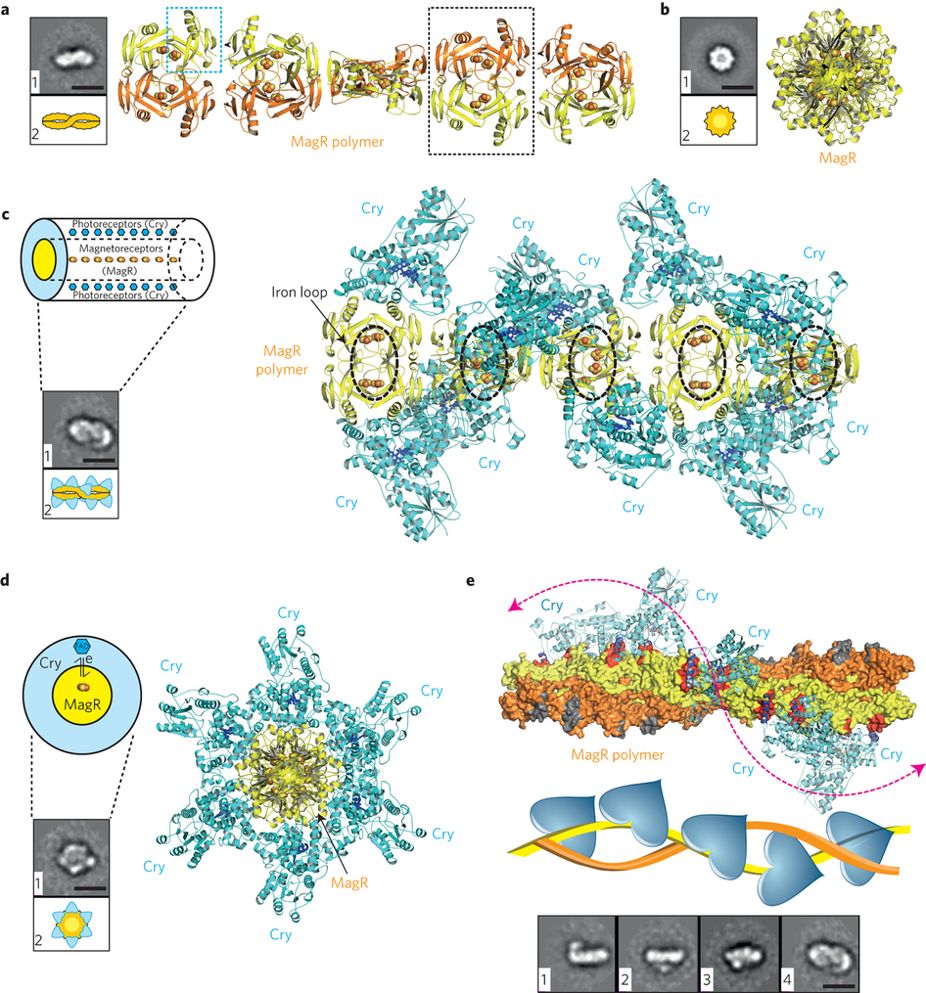
1.4.1 生物磁感应现象 9
1.4.2 磁受体蛋白MagR结构和作用机制 9
1.4.3 磁蛋白标签的应用前景 10
1.5 研究目标、研究内容和研究意义 10
1.5.1 研究目标 10
1.5.2 研究内容 11
1.5.3 研究意义 11
2.材料和方法 12
2.1 仪器和设备 12
2.2 材料试剂 13
2.3 实验方法 15
2.3.1 设计合成引物 15
2.3.2 质粒PCR扩增目的片段 15
2.3.3琼脂糖凝胶电泳 16
2.3.4 酶切连接 16
2.3.5 感受态细胞的制备 16
2.3.6 转化 16
2.3.7 菌落PCR 17
2.3.8 目的蛋白的原核表达 17
2.3.9 纯化目的蛋白 17
2.3.10 SDS-PAGE凝胶电泳 17
2.3.11 BCA法测定蛋白质浓度 18
2.3.12 LB和M9培养基中外源蛋白的表达对细菌生长的影响 19
2.3.13 AidH内酯酶活性测试 19
3.结果与讨论 20
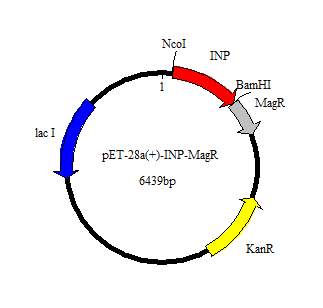
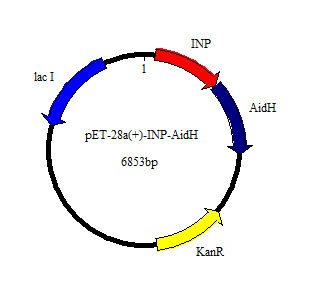
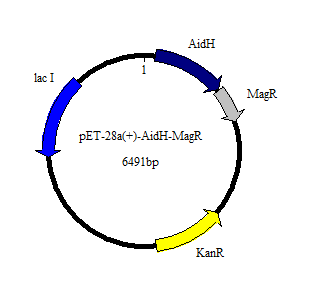
3.1 AidH-MagR重组蛋白的构建 20
3.1.1重组质粒pET28a-MagR-AidH的构建 20
3.1.2 质粒提取及酶切纯化 20
3.1.3 讨论 21
3.1.4 小结 21
3.2 AidH的原核表达 21
3.2.1 不同温度对外源蛋白原核表达的影响 21
3.2.2 LB和M9培养基中外源蛋白的表达对细菌生长的影响 22
3.2.3 不同IPTG浓度对外源蛋白原核表达的影响 22
3.2.4 Ni-NTA纯化目的蛋白 23
3.2.5 AidH内酯酶功能测试 24
3.2.6 讨论 24
3.2.7 小结 25
4.结论与展望 26
4.1 结论 26
4.2 展望 26
致 谢 27
参考文献 28
1.绪论
1.1 重组蛋白的原核表达和真核表达
1.1.1重组蛋白的构建
重组蛋白是指利用基因工程相关技术手段对DNA或RNA进行改造而获得的蛋白质。由于基因功能最终通过其表达产物—蛋白质来实现,因此重组蛋白质的表达对于蛋白质结构功能的研究以及实际应用具有重要意义。目前已经利用基因工程技术获得胰岛素、干扰素-α、干扰素-β、干扰素-γ和表皮生长因子等医药产品。随着科学进步的发展,重组蛋白的市场需求也日益增多,为了获得高纯度且功能稳定的重组蛋白,基因重组技术必不可少。重组蛋白的生产过程如图1.1所示。首先构建重组表达载体,获取编码所需蛋白的目的基因并根据基因长度选择合适的载体,将目的基因与载体DNA经限制性酶切后得到的片段进行连接,最后转入感受态细胞中进行重组子筛选。将筛选后得到的构建正确的重组体在液体培养基中培养,在特定的生长阶段,通过添加化学诱导物诱导重组蛋白的产生,然后通过裂解使细胞中释放重组蛋白,最后对重组蛋白进行收集和纯化。
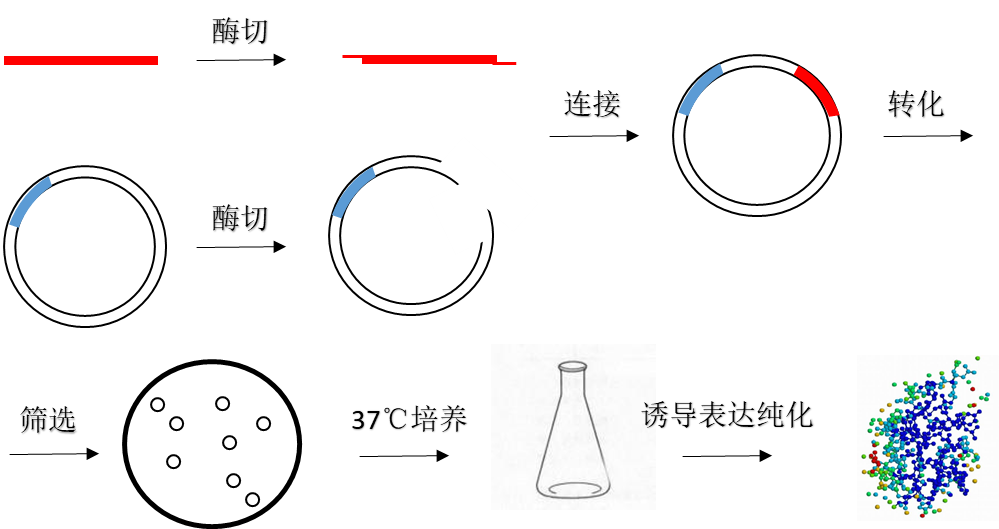
图1.1 重组蛋白的生产过程
1.1.2真核表达系统
由于原核细胞缺乏翻译后修饰的分子机制,真核蛋白在原核细胞中难以正确表达,在原核细胞中表达的真核蛋白往往不能被正确折叠和修饰,其生物活性也会受到影响。原核细胞的RNA聚合酶不能识别真核生物的启动子,真核生物基因表达的蛋白质往往会被原核细胞分泌的蛋白酶所水解,真核细胞和原核细胞在转录翻译过程中具有不同的密码子偏好性,这些都将对真核蛋白原核表达造成阻碍。综上所述,对于真核蛋白来说,选择一种功能稳定且成本低廉的真核表达系统是非常必要的。真核表达系统一般包括酵母表达系统、昆虫杆状病毒表达系统以及哺乳动物细胞表达系统。
酵母表达系统不仅具有原核表达系统操作简单、成本低廉、蛋白表达量高、生长速度快的优点,还具有真核表达系统能够加工修饰外源蛋白的优点,因此成为实验室中最常用真核表达系统。但酵母表达系统也具有一定的局限性,如缺乏强有力的启动子、分泌性差、质粒易丢失,与哺乳细胞相比只能表达一些修饰相对简单的蛋白质等。目前已经利用酵母成功表达异源蛋白IFN-α和IFN-γ[1],在工业方面酵母主要用于生产酒精[2]。
昆虫杆状病毒表达系统的建立得益于核型多角体病毒(nuclear polyhedresis viru,NPV)多角体蛋白的性质。多角体蛋白基因具有很强的启动子,使得蛋白的表达量很高,同时Fraser等人发现多角体蛋白基因的缺失并不会对病毒复制影响[1]。昆虫杆状病毒表达系统能够加工修饰蛋白使其具有生物活性,并且能同时表达多个基因,这些优点都有利于其作为一种理想的真核细胞表达系统。尽管昆虫杆状病毒表达系统具有很多优点,但也存在一些不足之处:由于该病毒会导致宿主死亡,所以每一轮外源蛋白的表达必须感染新的宿主,这不仅提高了成本,也耗时耗力。昆虫细胞表达系统与用哺乳细胞表达系统表达的外源蛋白糖基化方式仍然有所差异,因此利用昆虫杆菌病毒表达系统表达外源蛋白可能会出现修饰错误进而影响其生物活性的现象。目前Li等人成功在昆虫杆状表达系统中表达了融合蛋白IFNγ-CSA,能够大大延长IFNγ的半衰期[3]。
哺乳细胞表达系统能够完成转录后加工和翻译后修饰等过程,使得外源蛋白正确折叠并具有与天然蛋白几乎一致的结构和糖基化方式。CHO细胞表达的蛋白质药物产品包括用于治疗癌症和促红细胞生成素的单克隆抗体疗法。虽然哺乳细胞在获得具有天然结构的蛋白质上有着绝对的优势,但其成本昂贵、操作复杂、培养时间长等缺点使得该系统无法在实验中被广泛使用。
1.1.3原核表达系统
由于原核系统表达重组蛋白的方法也比较简单,可以表达的蛋白种类也比较多,同时原核细胞生长速度快且操作简单,与真核表达系统相比培养成本较为低廉,多数基因克隆和表达实验都首选在原核表达系统中进行。原核表达系统主要包括大肠杆菌表达系统和枯草杆菌表达系统。
枯草芽孢杆菌是属于非致病微生物,安全性高,生长速度快,培养成本低,具有高效的分泌蛋白的能力,能直接将蛋白释放到培养基中,在分离纯化方面优于大肠杆菌。虽然分泌的真核来源的重组蛋白在多数情况下都具有天然构象和生物活性,但该系统的缺点也非常明显,枯草芽孢杆菌会分泌各种降解外源蛋白的蛋白酶,转入宿主的质粒稳定性也比较差,有可能出现培养几代后质粒丢失的现象。同时枯草芽孢杆菌能自发形成感受态的菌株极少,形成的感受态持续时间也非常短暂,因此分子克隆效率很低。鉴于以上缺点,枯草芽孢杆菌系统在实验中并不常用。
大肠杆菌表达系统是最常用的原核表达系统,该菌种成本低,生长繁殖快,操作简单且易得到大量产物,在实验室和工业中具有长期安全使用的谱系。虽然该系统具有很多显著的优点,但其缺点也不容忽视。大肠杆菌作为重组蛋白质宿主的主要缺点是它不能像哺乳细胞一样进行蛋白翻译后修饰,因此许多产物都不具有天然活性。此外,有些外源蛋白对表达系统有一定的毒害作用,外源蛋白的过量表达可能会导致宿主裂解死亡。由于表达过快重组蛋白常以包涵体的形式存在,这也为产物纯化带来了一定的困难。但对于不需要糖基化或广泛翻译后修饰的蛋白质,该系统无疑是一种优秀的表达系统。目前,利用大肠杆菌易被改造的特性已生产出多种工程菌株,如Novagen公司的大肠杆菌BL21菌株缺失lon和ompT蛋白酶,能减少对重组蛋白的降解。
1.2 大肠杆菌pET系统表达重组蛋白
pET系统是有史以来在E.coli中克隆表达重组蛋白的功能最强大的系统,因此常常用于重组蛋白生产(图1.2)。该系统依赖于携带有编码T7噬菌体的RNA聚合酶基因的工程化大肠杆菌宿主。T7 RNA聚合酶基因通常受到异丙基β-D-1-硫代吡喃半乳糖苷(IPTG)诱导型启动子:如lacUV5的控制。该构建体能够稳定地掺入DE3基因座的细菌染色体中,在不存在IPTG的情况下,阻遏物LacI结合lac启动子从而抑制转录,导致T7 RNA聚合酶不能合成。加入IPTG后,LacI从lac启动子区释放,T7 RNA聚合酶基因被转录和翻译。随后T7 RNA聚合酶激活位于pET表达质粒上的T7启动子,促使其转录下游克隆的目的重组基因。最重要的是,pET表达质粒上的T7启动子未被大肠杆菌RNA聚合酶激活,因此目的基因是否表达取决于IPTG是否诱导。
Novagen公司的pET-28a表达载体是对上述T7表达系统的优化,该载体使用了T7启动子,尽管T7启动子不受大肠杆菌RNA聚合酶识别,但为了防止BL21(DE3)染色体上的placUV-T7聚合酶渗漏表达出少量T7聚合酶进而引发pET-28a上的T7启动子表达外源基因,在T7启动子与多克隆位点之间还是添加了lacO位点,进一步用lacI阻遏蛋白抑制载体上的T7启动子。
pET系统种类丰富,标签小,可提供各种不同融合标签和表达系统配置,有许多宿主菌株可以被制成感受态细胞用于转化,同时它也是所有大肠杆菌表达系统中基础表达水平最低和目的基因表达水平最高的系统。当然pET系统也不可避免地进行相对较高的本底转录,如果目的基因产物对大肠杆菌有毒性也会影响细胞的生长。目前的pET载体主要分为转录载体和翻译载体。转录载体翻译目标RNA,但不提供翻译信号。用于从自身带有细菌翻译信号的目的基因表达蛋白的转录载体,如pET-21、pET-23和pET-24。翻译载体含有设计用于蛋白表达的有效反应起始信号,许多载体在读码框中带有克隆位点。虽然该系统有着一些缺点,但瑕不掩瑜,未来pET系统的种类将会更加丰富,应用也会更加广泛。
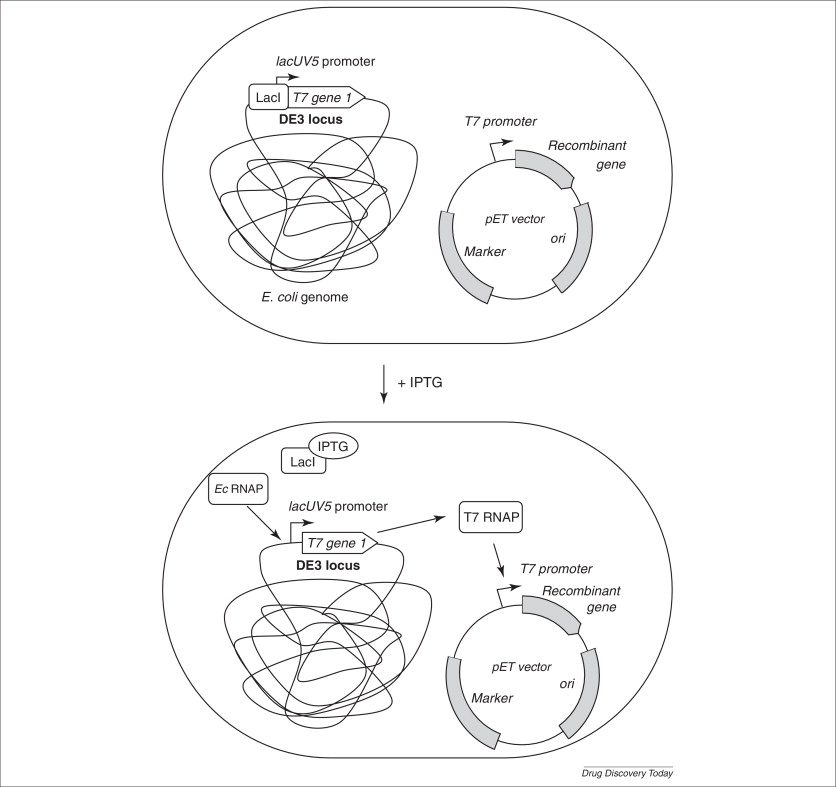
图1.2 pET系统示意图
1.3 AidH蛋白
1.3.1群体感应效应和群体感应信号分子
细菌群体感应 (Quorum Sensing,QS)是细菌间通过传递信号分子调控群体密度及生理特性的一种机制[4]。细菌利用群体感应调控一系列表型,并在生长过程中分泌一种被称为自诱导物的化合物,该化合物能在环境中积聚和扩散。细胞周围高浓度的自诱导物可诱导新陈代谢相关蛋白大量表达,其中某些分泌物可促使其周围细胞生长[5, 6]。群体感应效应最初在海洋费氏弧菌(Vibrio fischeri)中发现,当细菌群体数量足够密集时会产生荧光,有利于该细菌的生存。目前对群体感应效应的合理解释是:自诱导物的浓度可以代表细胞的密度,微生物在估算特定环境中的细胞密度后可以以一种协调的方式进行合作。细胞可以通过调节密度依赖性表型的表达,如释放毒力因子或分泌酶,使它们仅在有利于细胞自身时表达[7]。 群体感应的优势也会受扩散条件的影响,这一特性将有利于多个群体感应信号的演变[5]。
参与群体感应效应调控的信号分子依据其结构分为:N-酰基-高丝氨酸内酯(AHLs)、自诱导肽(AIPs)、自诱导物-2(AI-2s)、假单胞菌喹诺酮(PQS)、扩散因子(DSF)和羟基棕榈酸甲酯(PAME)。AHLs是革兰氏阴性菌之间进行信息交流的主要信号分子[8],可以影响和控制许多有利于细菌生命活动的重要表型,例如细菌运动能力的产生、毒力因子的表达以及生物膜的建立等等[4, 9, 10]。AHLs 在植物致病机制以及人类疾病感染中也发挥了重要作用,为预防细菌侵染动、植物提供了新的突破方向。AHLs中的高丝氨酸内酯环结构高度保守,各类信号分子的区别在于其侧链的碳链长度和取代基的种类[11](图1.3)
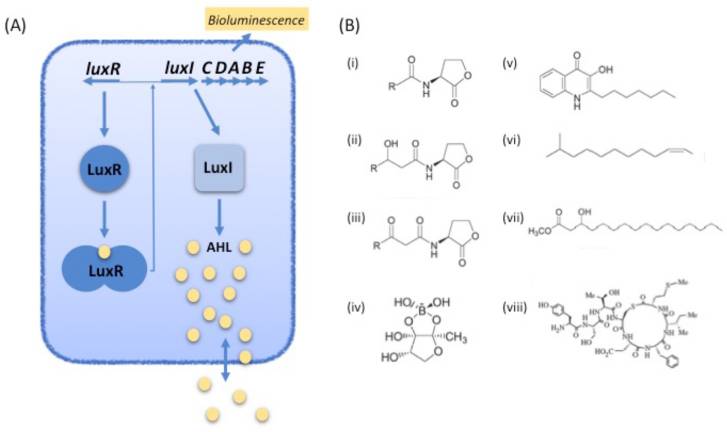
图1.3 几种典型性的群体感应信号分子
以上是毕业论文大纲或资料介绍,该课题完整毕业论文、开题报告、任务书、程序设计、图纸设计等资料请添加微信获取,微信号:bysjorg。
相关图片展示: