木聚糖酶的异源分泌表达及酶活分析毕业论文
2020-04-15 20:38:51
摘 要
Abstract II
第一章 综述 1
1.1 生物质能源简述 1
1.2 木聚糖酶概述 1
1.2.1 半纤维素与木聚糖 1
1.2.2 木聚糖酶的分类 2
1.2.3 木聚糖酶性质 3
1.2.4 木聚糖酶在工业中的应用 3
1.3 木聚糖酶的基因工程 5
1.4 该论文研究工作及意义 6
第二章 实验材料与方法 7
2.1实验材料 7
2.1.1实验试剂 7
2.1.2质粒与菌株 8
2.1.3实验仪器 8
2.1.4主要溶液及培养基的配制 9
2.2实验方法 11
2.2.1阳性转化子的筛选 12
2.2.2重组菌株的筛选 12
2.2.3毕赤酵母的诱导表达 13
2.2.4木聚糖酶酶活测定 13
2.2.5考马斯亮兰法测蛋白浓度 14
2.2.6蛋白质的分离与纯化 15
2.2.7蛋白电泳 15
2.2.8酶学性质测定 17
第三章 结果与讨论 18
3.1阳性转化子的筛选 18
3.2重组菌株的筛选 18
3.3木聚糖酶酶活测定 18
3.3.1木糖标准曲线 18
3.3.2木聚糖酶酶活的测定 19
3.4蛋白质浓度的标准测定方法 20
3.4.1蛋白质标准曲线的测定 20
3.4.2粗酶液蛋白含量的测定 20
3.5纯化蛋白酶活的测定 21
3.6重组木聚糖酶的SDS-PAGE分析 22
3.7酶学性质的测定 22
3.7.1酶的最适温度测定 22
3.7.2酶的最适pH测定 24
第四章 结论与展望 26
4.1结论 26
4.2展望 26
摘 要
本实验选用毕赤酵母作为表达的宿主系统来表达厌氧真菌Neocallimastix patriciarum的木聚糖酶基因。通过构建该基因的重组质粒pPIC9K-xynNP,经线性化处理后电击转化入表达宿主毕赤酵母GS115中,构建重组菌株并诱导表达。本实验通过遗传霉素抗性平板来筛选重组毕赤酵母。在摇瓶发酵水平,重组菌株所产木聚糖酶活性最高达到了1766.2 U/ml。通过SDS-PAGE凝胶电泳实验确定重组木聚糖酶大小为35 kDa。酶学性质研究表明,A37和A15菌株所产木聚糖酶的最适反应温度均为55℃。A15菌株所产木聚糖酶的最适反应pH为7.0,A37菌株则为6.4。
关键词:木聚糖酶 巴斯德毕赤酵母 酶学性质 异源表达
Abstract
In this experiment, Pichia pastoris was used as the host system for expression to express the xylanase gene of the anaerobic fungus Neocallimastix patriciarum. The recombinant plasmid pPIC9K-xynNP was constructed, and after linearization, it was electroporated into the expression host Pichia pastoris GS115 to construct a recombinant strain and induce expression. This experiment screened recombinant Pichia pastoris by geneticin resistant plates. At the shake flask fermentation level, the xylanase activity of the recombinant strain reached a maximum of 1766.2 U/ml. The size of the recombinant xylanase was determined to be 35 kDa by SDS-PAGE gel electrophoresis. Enzymatic properties studies showed that the optimal reaction temperature of xylanase produced by A37 and A15 strains was 55 °C. The optimum pH for the xylanase produced by the A15 strain was 7.0, and that of the A37 strain was 6.4.
Key words: xylanase;Pichia pastoris;enzymatic propertie;heterologous expression
第一章 综述
1.1 生物质能源简述
自然界中的植物能够以自身为媒介存储太阳辐射能,这种由植物所存储的能量就是我们所谓的生物质能源。太阳辐射能源极为巨大,因而生物质能是一种可以长久利用,源源不断的新型能源。生物质能的存储方式多种多样,主要形式有树木、农业及森林的残留物、人类和动物的排泄物、能源作物还有食品加工过程中的废弃物等等[1]。植物通过光合作用生成生物质能,由于自然界植物储量丰富,因而生物质能几乎是可以永续使用的。生物质中S和N元素含量甚微,因此在燃烧过程中产生的二氧化硫和二氧化氮等有毒有害气体较少,对大气造成污染较低,一定程度上也减轻了温室效应。由于生物质能的低污染性,其被认为是可以替代传统能源的最有前景的物质之一。在传统石油能源价格飞涨以及环境保护呼声高涨的当下,开发利用更为环保的生物质能尤为重要。
半纤维素是由多种不同的木糖构成的,结构复杂多样。在这几种多糖中,木聚糖的成分是最多的。随着木聚糖酶在生物质的能源领域、造纸领域、食品领域中得到了越来越广泛地利用,但天然木聚糖酶的弊端也日益凸显。天然木聚糖酶的降解效率低下,且生产成本高,因此开发具有良好的稳定性、耐高温和酸碱环境、催化效率高的木聚糖酶已经成为当前研究的热门方向。在自然界中,木聚糖酶的身影随处可见,但是自然界所产的木聚糖酶大多只能在酸性或中性的条件下进行催化反应,并且最适pH范围较窄,最适温度往往也比较低,不适用于实际生产应用。随着基因工程的进一步发展,在基因水平改造菌体已经日趋成熟。
1.2 木聚糖酶简介
1.2.1木聚糖和半纤维素
当前全世界的能源使用结构仍然是以煤、石油、天然气三大传统能源为主,传统能源的利用导致大量碳排放,进而使得全球气温上升,破坏生态平衡。在全球能源日益短缺和自然环境饱受破坏的当下,开发利用更为环保的新能源迫在眉睫。植物纤维作为生物质能的主要组成部分,其开发利用受到了广泛的重视。植物纤维壁主要是由纤维素、半纤维素和木质素等构成[2]。半纤维素在多种领域都有应用,如在化工、食品、药品等工业生产。在生物和医药行业中,磷酸化的木聚糖既有抗凝血的作用,半纤维素则可以预防和治疗变性关节炎疾病[3]。在造纸工业中,木聚糖能够使打浆的阻力加倍,阳性木聚糖则具有抗菌性。在涂料生产中,木聚糖具有低特性黏度和热塑性[4]。木聚糖是半纤维素的重要组分之一,也是构成细胞壁的重要组分[5]。木聚糖的结构复杂,是由多种不同的木糖聚合而成的杂合分子[6-7]。来自不同植物或者同一植物不同生长阶段的木聚糖具有不均一性,因此彻底水解木聚糖需要多种酶的共同参与[8]。
1.2.2 木聚糖酶分类
就木聚糖酶的活性而言,真菌普遍高于高于细菌。一般而言,微生物所产的木聚糖酶均属于诱导型[3]。木聚糖酶在自然界物质循环中扮演着至关重要的作用,木聚糖酶能够降解纤维素,在给微生物提供能量的同时,也维持了大自然中CO2的平衡。木聚糖酶是降解半纤维素的关键酶,主要作用于木聚糖主链上的β-1,4-糖苷键,木聚糖酶种类繁多,主要可以分为外切木聚糖酶和内切木聚糖酶以及木糖苷酶[9]。
表 1-1木聚糖降解酶系 | ||
木聚糖酶系 | 系统名 | 作用方式 |
β-1,4-内切木聚糖酶 | EC 3.2.1.8 | 作用于β-1,4-木聚糖主链内部的木糖苷键,将木聚糖降解为低聚木糖,以及少量的木糖、阿拉伯糖和甘露醇 |
β-1,4-外切木聚糖酶 | EC 3.2.1.92 | 将内切木聚糖酶产物低聚木糖和木聚糖水解为木糖 |
β-木糖苷酶 | EC 3.2.1.37 | 将内切木聚糖酶的产物低聚木糖水解为木糖[24] |
a-L-呋喃阿拉伯糖苷酶 | EC 3.2.1.55 | 降解木聚糖侧链,加速低聚木糖的产生[25] |
β-木糖苷酶 | EC 3.2.1.37 | 作用于木寡糖的末端,释放木糖残基,是唯一能够降解木二糖的酶 |
乙酰木聚糖酯酶 | EC 3.2.1.6 | 降解乙酰化木聚糖,并且与内切木聚糖酶协同作用 |
a-葡萄糖醛酸酶 | EC 3.2.1.1 | 帮助降解木聚糖侧链,加速低聚木糖的产生 |
1.2.3 木聚糖酶性质
研究发现,来自不同生物的木聚糖酶其理化性质和结构存在着很大的差异。在结构、最适温度和最适pH方面,细菌和真菌所产木聚糖酶有着很大的差异:(1)就结构而言,细菌蛋白质亚基单一,可以分为高分子量的耐酸木聚糖酶和低分子量的耐碱木聚糖酶[3]。而真菌所产的木聚糖酶蛋白质亚基相对要复杂很多,且分子量的差异较大[3]。10-11]。(2)从最适pH和酸碱耐受性来看,细菌木聚糖酶催化环境多为中性或弱碱性,最适pH区间为6.0-8.0[10-11]。真菌木聚糖酶催化环境则多为中性或者弱酸性,最适pH区间为4.0-6.0[21-23]。一般而言,真菌的的酸碱耐受性往往低于细菌,因为细菌的生长环境相对于真菌而言较为严苛。
1.2.4 木聚糖酶的应用
1.在造纸上的应用
造纸用纤维原料取自树木,这对于森林资源稀缺的国家而言,不利于经济的可持续发展,而且加重了环境保护的压力。目前国内造纸采用的方法仍然以亚硫酸盐法制浆为主,用大量的氧化性含氯化学试剂对纸浆进行漂白,例如氯气、二氧化氯等等[12],产生致癌的氯的次生物[3],对于环境和人体危害极大。造纸工业中的废水中也存在有毒、致癌的氯的次生物,会对周边生态环境造成严重的污染。因而探索一种环保且可持续的纸浆制造工艺显得尤为重要。开发和利用废纸的二次纤维是近年来研究得比较多的课题,木聚糖酶在纤维质原料的脱皮、纸浆精化和纤维素纯化等方面提供了崭新的思路[13]。
木聚糖酶能够水解纤维表面的木聚糖,使得纸张纤维表面出现很多孔道,通过这些孔道,化学试剂更容易渗入纤维内部,使的木质素能够更好地溶出,最终达到漂白的效果[14-15]。另外,由于纸浆中的木质素被溶出,纸浆成品的强度也会得到提升,纸浆性能可以得到大幅度的优化。如果在化学漂白之前,用木聚糖酶对纸浆进行预处理,就会使氯气、二氧化氯等化学漂白剂更好地渗透进纸浆内部,从而大大减少化学漂白剂的用量[3],生产成本也得到了降低,同时还能回收高分子木质素[30]。
2.在食品上的应用
木聚糖酶在食品行业的应用主要是体现在木聚糖酶能够从棉壳、甘蔗渣、玉米皮、玉米芯等天然的食物半纤维中分解得到木糖和低聚木糖[16]。进一步可生产木糖醇,用于替代糖类在食品中的添加。木糖醇的甜度很高并且不会被人体肠道所吸收,因而食用木糖醇不会引起人体血糖浓度的升高,通常可以作为糖尿病或者肥胖患者的甜味剂[17]。此外,低聚木糖还具有极高的双歧杆菌的增殖活性,因而可以帮助降低人体内的胆固醇含量[3]。低聚木糖还能够促进人体钙离子的吸收,可有效防止龋齿。
在酿酒行业中,木聚糖酶可以帮助提高淀粉的利用率,从而减少酿酒残渣的产生。尤其是在啤酒生产中,加入木聚糖酶可以有效降低发酵液的粘稠度,避免堵塞滤膜,从而提高了生产的效率。在面包生产中也多有木聚糖酶的身影,面包生产中加入木聚糖酶,可以帮助改善面包的口感、结构[17],使得面包的保质时间更长久。此外,在食品添加剂中,也可看到木聚糖酶的身影,木聚糖酶的本质是一种蛋白质,将木聚糖酶用作添加剂,安全无毒,而且酶制剂的反应条件温和,对食物的口感不会产生影响,能够保留食物原本的风味[3]。
- 在饲料上的应用
我国的饲料总产量虽然高居世界第二,但是由于饲料的利用率低下,导致我国的饲料资源不容乐观。在小麦、大麦等谷物饲料中,木聚糖的含量高达8%左右,在麸皮中甚至达到了21.9%。但是对于非反走动物而言,木聚糖是没有任何营养的。除此之外,木聚糖还会促使动物肠道中食糜体积增大,黏度增加,从而形成凝胶,扰乱一些内源消化酶的功能以及吸收,这是造成饲料利用率低下的根本原因[3]。由于消化吸收受阻,动物的生长周期也会变长。木聚糖酶或者其他半纤维素酶的加入可以有效解决这一类问题,木聚糖可以被木聚糖酶降解为木糖和其他低聚木糖,可以有效降低消化道的黏度,动物肠道壁对养分的吸收得到了大幅度提升,从而提升了饲料的利用率,降低了养殖成本。在家禽饲料中添加木聚糖酶能够帮助减少家禽肠道疾病的染病率。另外,由于饲料被木聚糖酶进一步分解,饲料中被植物细胞壁锁住的营养成分也得到了进一步的释放,提高养分的利用率[18]。
- 在能源行业上的利用
在传统石油能源价格飞涨以及环境保护呼声高涨的当下,开发利用更为环保的生物质能尤为重要。据统计,在发展中国家,生物质能在其原始能源消费中贡献率达到35%,而在工业国家里也可以达到3%[28]。半纤维素是生物质能中重要的一员,半纤维素在自然界中含量丰富,仅次于纤维素[19]。燃料乙醇作为一种新型能源可以替代传统的化石能源,在带来巨大经济收益同时,还不会对环境造成污染[20]。
1.3 木聚糖酶的基因工程
随着基因工程的兴起,尤其是DNA重组技术的发展成熟,木聚糖酶基因在许多表达系统中得到了表达,甚至有一些木聚糖酶得到了高效表达[3]。常见的表达系统有大肠杆菌表达系统、毕赤酵母表达系统、烟草表达系统和枯草芽孢杆菌表达系统等等[26]。
酵母细胞具有一套完善的蛋白质加工修饰系统,可以对外源的蛋白进行修饰,折叠加工,生成具有稳定构象的活性蛋白质。酵母细胞的蛋白分泌量高,易于提纯,经过简单的破碎离心即可收获粗蛋白。酵母细胞本身安全性高,酿酒酵母可被用于食品行业,且无内毒素污染。毕赤酵母表达系统相对于其他酵母优势最为显著,携带外源基因的表达载体通过单交换或者多拷贝插入方式整合到酵母基因上,遗传和表达较稳定,能实现外源蛋白的胞外分泌[29]。毕赤酵母作为真核表达宿主,可对翻译转录的蛋白进行正确的折叠和后修饰(糖基化和磷酸化等)[3]。毕赤酵母基因组中含有外源基因表达时需要AOX(Alcoholoxidase 1)强启动子,经甲醇诱导可实现外源基因的高效表达[30]。许多研究者利用毕赤酵母成功表达了木聚糖酶基因并对其酶学性质进行了分析。
1.4 该论文研究工作及意义
自然界中,天然状态下的微生物木聚糖酶分泌表达量较低,因而不适用于大规模生产,且生产成本高昂,商业化价值低。此外,天然木聚糖酶的催化环境较为温和,但实际的生产环境多为高温或强酸碱环境,极其严苛。因此,天然来源木聚糖酶无法参与到实际的生产应用[27]。近年来,异源表达系统研究的深入为木聚糖酶大规模生产及应用提供了可能性。而其中,作为真核表达系统的毕赤酵母有着其他表达系统不可比拟的优越性[30]。因此,本论文选用毕赤酵母作为表达的宿主系统表达来自厌氧真菌Neocallimastix patriciarum的木聚糖酶基因,并对该重组木聚糖酶的基本酶学性质进行了探究。
第二章 实验材料与方法
2.1实验材料
2.1.1实验试剂
表2-1实验试剂及其生产厂商 | |
实验试剂 | 生产厂商 |
琼脂糖(agarose) | 生工生物工程(上海)有限公司 |
dNTPs(10mM) | 生工生物工程(上海)有限公司 |
PCR纯化试剂盒 | 爱思进(Axygen)生物技术(杭州)有限公司 |
凝胶回收试剂盒 | 爱思进(Axygen)生物技术(杭州)有限公司 |
YNB | 生工生物工程(上海)有限公司 |
D-xylose | 生工生物工程(上海)有限公司 |
D-glucose | 生工生物工程(上海)有限公司 |
agar A | 生工生物工程(上海)有限公司 |
Yeast extract | 英国Oxoid公司 |
Peptone | 英国Oxoid公司 |
Tryptone | 英国Oxoid公司 |
遗传霉素(Geneticin) | 生工生物工程(上海)有限公司 |
TritonX-100 | 英国Oxoid公司 |
SDS | 英国Oxoid公司 |
EDTA | 生工生物工程(上海)有限公司 |
Biotin(生物素) | 生工生物工程(上海)有限公司 |
甲醇 | 生工生物工程(上海)有限公司 |
甘油 | 生工生物工程(上海)有限公司 |
柠檬酸 | 生工生物工程(上海)有限公司 |
木聚糖 | 生工生物工程(上海)有限公司 |
磷酸氢二钠 | 生工生物工程(上海)有限公司 |
磷酸二氢钠 | 生工生物工程(上海)有限公司 |
山梨醇 | 生工生物工程(上海)有限公司 |
2.1.2质粒与菌株
表2-2质粒与菌株 | |
质粒与菌株 | 生产厂商 |
重组pPIC9K质粒 | 实验室提供 |
GS115毕赤酵母 | 实验室提供 |
2.1.3实验仪器
表2-3实验仪器及其生产厂商 | |
实验仪器 | 生产厂商 |
浸入式电泳槽(水平) | 美国伯乐 |
电泳槽(垂直) | 美国伯乐 |
基础电泳仪电源 | 美国伯乐 |
成像系统 | 美国伯乐 |
暗箱式紫外分析仪 | 巩义市予华仪器有限责任公司 |
洁净工作台 | 青岛海尔特种电器有限责任公司 |
低温小型离心机 | 德国艾本德股份公司 |
台式大容量冷冻离心机 | 德国艾本德股份公司 |
三孔分控恒温水槽 | 上海汗诺仪器有限公司 |
恒温培养振荡器 | 上海智城仪器制造有限公司 |
超声波细胞粉碎机 | 宁波新芝 |
可见/紫外分光光度计 | 岛津公司 |
超纯水系统 | 南京易普易达科技发展有限公司 |
烘箱 | 海门新苗公司 |
pH计 | 雷磁 |
分析天平 | 赛多斯科仪器有限公司 |
PCR扩增仪 | 德国麦德龙股份公司 |
Eppendorf移液器 | 艾本德中国有限公司 |
立式自动压力蒸汽灭菌锅 | 合肥华泰医疗设备有限公司 |
4℃冰箱 | 合肥美菱股份有限公司 |
离子交换柱 | 英国通用电气(GE)医疗集团 |
2.1.4主要溶液及培养基的配制
1.主要溶液
配制方法如下表:
表2-4实验用主要溶液 | |
溶液名称 | 溶液配制方法 |
三硝基水杨酸(DNS) | 将6.3 g DNS溶于500 ml的温水中(45℃)中,溶解后加入262 ml 2 mol/L NaOH溶液,然后加入182 g酒石酸钾钠,不断搅拌,溶解后加入5 g亚硫酸钠,待溶解后再加入5 g结晶酚,待溶解冷却后加水定容至1000 ml,存放在棕色瓶中,于暗处放置一星期后使用 |
1 mg/ml标准木糖溶液 | 准确称取经80℃干燥至恒重的木糖100 mg,于适量蒸馏水中溶解,转入容量瓶中定容至100 ml |
pH=7.2的柠檬酸缓冲液 | 86.95 ml 0.2 M Na2HPO4,13.05 ml 0.2 M 柠檬酸,湿热灭菌 |
1%木聚糖溶液 | 称取1 g木聚糖,加入约80 ml的pH=7.2的柠檬酸缓冲液配制溶解后,转移至100 ml容量瓶定容,4℃保存 |
考马斯亮蓝G-250蛋白试剂 | 称取100 mg考马斯亮蓝G-250,溶于50 ml 90%乙醇中,加入85%(m/v)的磷酸100 ml,最后用蒸馏水定容到1000 ml |
标准蛋白质溶液 | 称取10 mg牛血清白蛋白,溶于蒸馏水并定容至100 ml,制成100 μg/ml的原液。 |
磷酸钾缓冲液 | 取19 ml 0.2 mol/L的NaH2PO4,81 ml 0.2 mol/L的Na2HPO4 |
1 mol的山梨醇溶液 | 称取18.2 g的山梨醇溶入蒸馏水后在无菌操作台中过滤除菌 |
2.主要母液
配制方法如下表:
表2-5 主要母液的配制 | |
母液名称 | 母液配制方法 |
10*YNB | 称取134 g YNB培养基(含硫酸铵),定容到1000 ml,过滤除菌,放到4℃保存 |
500*B | 称取20 mg的生物素溶于100 ml水中,过滤除菌,4℃保存 |
10*D | 200 g葡萄糖溶于1000 ml水中,115℃灭菌15 min |
10*M | 按照体积比1:20配置甲醇水溶液后过滤除菌 |
10*GY | 按照体积比1:10配置甘油水溶液后过滤除菌 |
3.主要培养基
配制方法如下表:
表2-6主要培养基的配制 | |
培养基名称 | 培养基配制方法 |
YPD固体培养基 | 按照胰蛋白胨 2%,酵母膏 1%,氯化钠1%,琼脂粉 1.5%称取药品,加双蒸水至1000 ml,121℃高压灭菌20 min,无菌存放,用时微波至融化后倾倒平板 |
YPD液体培养基 | 按照胰蛋白胨 2%,酵母膏 1%,氯化钠1%,琼脂粉 1.5%称取药品,加双蒸水至1000 ml,121℃高压灭菌20 min,无菌存放 |
MD培养基 | 800 ml灭菌水中加入100 ml 10*YNB,2ml 500*B,100ml 10*D,4℃保存 |
BMGY培养基 | 胰蛋白胨20 g,酵母膏10 g加入700 ml去离子水中,121℃高压灭菌20 min,使用前在无菌操作台中加入100ml 1M pH6.0磷酸钾缓冲液,2 ml 500*B,100 ml 10*YNB,100 ml 10*GY |
BMMY培养基 | 胰蛋白胨20 g,酵母膏10 g加入700 ml去离子水中,121℃高压灭菌20 min,使用前在无菌操作台中加入100ml 1M pH6.0磷酸钾缓冲液,2 ml 500*B,100 ml 10*YNB,100 ml10*M |
2.2实验方法
重组质粒pPIC9K-xynNP的构建如下图,此外将目的基因插入毕赤酵母GS115的His4区,从而构建重组菌的工作也已有实验室完成。
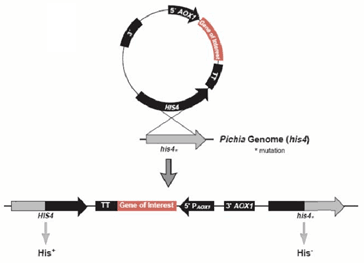
图 2-1重组质粒原理示意图
2.2.1阳性转化子的筛选
(1)加入1 ml预冷的山梨醇溶液将电击后的菌体重悬,保存在1.5 mlEP管中;
(2)将悬液后的菌体接种在MD平板上,培养温度为30℃;
(3)选取MD平板上的单菌落进行液体培养, 30℃,培养至对数期;
(4)取1 ml的菌液离心去上清液,用枪头粘取菌泥做为PCR模板;
(5)用通用引物5’AOX/3’AOX做PCR检测。
2.2.2重组菌株的筛选
本实验采用遗传霉素来进一步对重组菌株进行筛选。遗传霉素(G418,geneticin)能够阻断蛋白质的合成,对细菌、酵母、高等植物以及哺乳动物细胞均具有氨基糖苷类毒性。重组质粒中含有遗传霉素抗性基因,只有成功导入并表达遗传霉素抗性基因的菌株才能在含G418的YPD平板上生长。具体方法如下:
(1)配制遗传霉素含量分别为0.5、1、2、3、4 mg/ml的YPD平板;
(2)将MD平板上的转化子分别挑到每一个浓度的YPD平板上,30℃培养2-4天至长出明显菌落。
2.2.3毕赤酵母的诱导表达
(1)选取具有遗传霉素抗性的单菌落, 30℃,250 rpm/min,培养至OD600nm达到2-6;
(2)在常温下,1500×g离心后弃上清,将菌体重悬于100 ml的BMMY培养基。在28℃,转速为 250 rpm/min摇床上培养96 h;
(3)每24 h补加终浓度为1%(V)的无菌甲醇;
(4)每隔24 h取诱导1ml培养基,用台式离心机12000×g离心5 min,收集上清液,检测菌体浓度;
(5)菌体培养结束后,常温下,离心,取上清液4℃待用。
2.2.4木聚糖酶酶活测定
1.木糖标准曲线
按下表依次在试管中加入溶液,使反应体积为0.75 ml。
表2-7木糖标准曲线 | ||||||
编号 | 对照 | 1 | 2 | 3 | 4 | 5 |
木糖标准液 (uL) | 0 | 5 | 10 | 15 | 20 | 25 |
缓冲液pH6.0 (uL) | 1.5 | 745 | 740 | 735 | 730 | 725 |
DNS(ml) | 2 | 1 | 1 | 1 | 1 | 1 |
总体积(ml) | 10 | 5 | 5 | 5 | 5 | 5 |
加入1 ml的DNS溶液(对照为2 ml),混合均匀后,在沸水中煮沸5 min,在冰水中冷却到室温,加蒸馏水定容到5 ml(对照为10 ml),测OD540。
2.木聚糖酶酶活的测定
按下表依次在试管中加入溶液;
表2-8 木聚糖酶反应体系 | |
溶液名称 | 溶液剂量 |
磷酸钾缓冲液(pH=6.0) | 0.225 ml |
稀释过的粗酶液 | 25 μl |
0.5%木聚糖底物 | 0.5 ml |
50℃反应15 min(冰水终止反应),加入1 ml的DNS,充分混合,沸水浴5 min后冰水降温,补加蒸馏水至10 ml,测540nm。
2.2.5考马斯亮兰法测蛋白浓度
1.蛋白质标准曲线的制定
按照下表在试管中加入各种试剂,并且标记好。
表 2-9考马斯亮蓝法的标准曲线试剂 | ||||||
操作项目 | 管号 | |||||
1 | 2 | 3 | 4 | 5 | 6 | |
标准蛋白质溶液(ml) | 0 | 0.2 | 0.4 | 0.6 | 0.8 | 1.0 |
蒸馏水(ml) | 1.0 | 0.8 | 0.6 | 0.4 | 0.2 | 0 |
G-250试剂(ml) | 5 | 5 | 5 | 5 | 5 | 5 |
蛋白质含量(μg) | 0 | 20 | 40 | 60 | 80 | 100 |
将塞子盖好,摇晃试管使溶液混合均匀。将其在室温下放置5 min后,测OD595。
2.蛋白含量测定
(1)用纯水将粗酶液稀释10倍。A15和A37均做3个平行样,在离心管上做好标记;
(2)在离心管中加入5 ml的G-250溶液,盖上盖子,摇晃试管使溶液混合均匀,室温下放置2 min;
(3)测每管样品的OD595;
2.2.6蛋白质纯化
1.离子交换柱纯化重组木聚糖酶
(1)配制pH=6的磷酸钾缓冲液;
(2)离子交换柱以pH=6.0缓冲液冲洗1-2次(5-10 ml);
(3)向柱子中加入10 ml酶液,充分混匀,放出(重复几次,可一次性洗脱);
(4)用pH=6.0的磷酸钾缓冲液冲洗1-2次,每次5-10 ml;
(5)在每个柱子中加入咪唑5 ml,将吸附在柱子中的蛋白质洗脱下来。
洗脱的蛋白质和咪唑混合物以10 ml离心管保存,标记好,4℃下保存。在离子交换柱中加入20%的乙醇保存,置于4℃冰箱。
2.纯化后酶活的测定
于0.225 ml磷酸钾缓冲液(pH=6.0)中加入25 μl稀释过的粗酶液,再加入0.5 ml的0.5%木聚糖底物,在50℃下反应15 min(精确计时,取出后放入冰水中终止反应)。后续步骤同2.2.4。
2.2.7蛋白电泳
1.蛋白的制备
将收集到的蛋白质和Loading buffer 按照4:1的比例混合,沸水煮15 min,离心即得粗蛋白。
2.蛋白胶的配制
(1)装配好SDS-PAGE电泳装置,将板子冲刷干净并且用吹风机烘干表面水分;
(2)按照下表配制12%的分离胶;
表2‑ 10 分离胶配方 | ||||||
下层胶 | 10% | 12% | 15% | |||
5ml | 10ml | 5ml | 10ml | 5ml | 10ml | |
H2O | 1.9 | 4 | 1.6 | 3.3 | 1.1 | 2.3 |
30% 丙烯酰胺 | 1.7 | 3.3 | 2 | 4 | 2.5 | 5 |
1.5μTris(pH=8.8) | 1.3 | 2.5 | 1.3 | 2.5 | 1.3 | 2.5 |
10%SDS | 0.05 | 0.1 | 0.05 | 0.1 | 0.05 | 0.1 |
10%AP(过硫酸铵) | 0.05 | 0.1 | 0.05 | 0.1 | 0.05 | 0.1 |
TEMED | 0.002 | 0.004 | 0.002 | 0.004 | 0.002 | 0.004 |
(3)灌胶后,加异丙醇,静置1 h。带胶体凝固后,倒去异丙醇,用滤纸擦干板子。
(4)按照下表配制5%的浓缩胶;
表 2‑11浓缩胶配方 | |||
上层胶 | 2 ml | 4 ml | 6 ml |
H2O | 1.4 | 2.7 | 4.2 |
30% 丙烯酰胺 | 0.33 | 0.67 | 1 |
1.0μTris(pH=6.8) | 0.25 | 0.5 | 0.76 |
10%SDS | 0.02 | 0.04 | 0.06 |
10%AP(过硫酸铵) | 0.02 | 0.04 | 0.06 |
TEMED | 0.002 | 0.004 | 0.006 |
(5)混匀后加灌胶,加至漫出,将梳齿插入,静置使胶体凝固;
(6)拔掉梳子,组装电泳槽,将处理好的样品点到上样孔,准备跑胶。
3.跑蛋白胶
(1)取21 μl样品与7 μl的4×Buffer混匀,在95℃中反应5 min;
(2)点样:用10 μl marker做对照,样品用20μl点样,加满槽液;
(3)跑样:电压80 V跑30 min,120 V跑至绿线上方;
(4)染色:将跑完的胶在水中取出,加入考马斯亮蓝,低温时,用保鲜膜封住于微波炉低温15 s,连同保鲜膜一起摇1 h左右;
(5)脱色:用脱色液先冲洗一下,再加入脱色液摇,约半小时换一下,可过夜,直至条带清晰可见;
(6)拍照看胶:倒去脱色液,用清水冲洗胶,放于白板上看胶,照片标记保存。
2.2.8酶学性质测定
1.酶的最适温度测定
将稀释酶液和木聚糖溶液在45、50、55、60、65、70和80℃下反应15min,测酶活。
2.酶的最适pH测定
分别用pH5.8、6.4、7.0、7.4、8.0的缓冲液配制反应体系,在最适温度条件下反应15 min,测酶活。
第三章 结果与讨论
3.1阳性转化子的筛选
如图所示,在含有重组质粒的毕赤酵母基因组DNA中,利用通用引物5’AOX/3’AOX合成的木聚糖酶基因片段大约为1180bp,表明木聚糖酶基因已经导入了毕赤酵母基因组中。
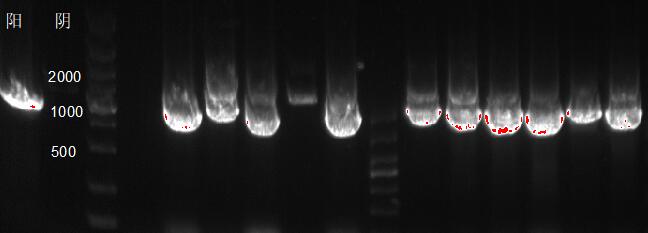
图 3-1 阳性转化子PCR验证图
3.2重组菌株的筛选
本实验在遗传霉素浓度为2 mg/ml的 YPD 平板上挑取了58个单菌落,将这58个单菌落编号并接种到BMMY培养基上进一步培养,测其酶活。其中以编号为A37和A15两棵菌株活性最高,因而用作后续实验。
3.3木聚糖酶酶活测定
3.3.1木糖标准曲线
按木糖标曲结果如图3-1所示。
图 3-2 木糖标准曲线
3.3.2木聚糖酶酶活的测定
A37和A15菌株酶活如下表所示
表3-1 A37菌株酶活结果 | ||||
编号 | A37-1 | A37-2 | A37-3 | A37-4 |
OD540 | 0.677 | 0.534 | 0.705 | 0.710 |
酶活力(U/ml) | 1037.1 | 830.5 | 1077.6 | 1084.8 |
表3-2 A15菌株酶活结果 | ||||
编号 | A15-1 | A15-2 | A15-3 | A15-4 |
OD540 | 0.786 | 0.756 | 0.718 | 0.845 |
酶活力(U/ml) | 1194.6 | 1151.2 | 1096.4 | 1279.8 |
A15和A37菌株的酶活测定均进行了四次平行实验,取其平均值的。A37 的酶活力为1007.5 U/ml,A15则达到了1180.5 U/ml。
3.4蛋白质浓度的标准测定方法
3.4.1蛋白质标准曲线的测定
蛋白质标曲绘制结果如图3-2所示。
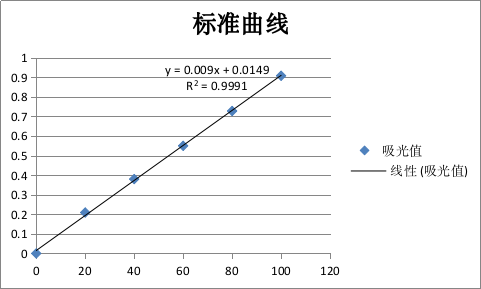
图 3-2蛋白质标准曲线
3.4.2粗酶液蛋白含量的测定
表3-3 A15菌株粗酶液蛋白含量测定结果 | |||
编号 | A15-1 | A15-2 | A15-3 |
OD595 | 0.084 | 0.247 | 0.229 |
蛋白含量 (μg/ml) | 76.78 | 257.89 | 237.89 |
表3-5 A37菌株粗酶液蛋白含量测定结果 | |||
编号 | A37-1 | A37-2 | A37-3 |
OD595 | 0.206 | 0.176 | 0.224 |
蛋白含量 (μg/ml) | 212.33 | 179.00 | 232.33 |
实验结果表明,A15菌株粗酶液的蛋白含量约为190.85 μg/ml,A37菌株约为207.89 μg/ml,A37菌株粗酶液的蛋白含量略高于A15。
3.5纯化蛋白酶活的测定
表3-6酶液纯化后酶活测定结果 | ||
编号 | A37 | A15 |
OD540 | 1.180 | 0.488 |
酶活力(U/ml) | 1766.2 | 765.1 |
实验结果表明,粗酶液在经过离子交换柱纯化后,酶含量增加,酶活提升。A37菌株纯化后的酶活高达1766.2 U/ml,相较于未纯化的酶液,其酶活力增长了758.7 U/ml。但是纯化后的A15菌株酶活力只有765.1 U/ml,相较于未纯化的酶液,其酶活反而大幅度下降。分析实验过程,推测其原因是,用于纯化的粗酶液在冰箱中保存时间过久,酶活性降低,导致其纯化后的酶活力不高。
3.6重组木聚糖酶的SDS-PAGE分析
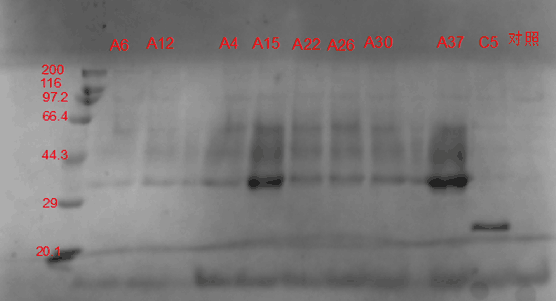
图 3-3 SDS-PAGE电泳图谱
如电泳图谱所示,实验菌株表达的木聚糖酶的大小约为35 kD。在进行电泳的9个菌株中,以A15和A37菌株的表达量最高,因而被选用于后续实验。
3.7酶学性质的测定
3.7.1酶的最适温度测定
图 3-3温度对木聚糖酶酶活的影响
(A: A15; B:A37)
结果表明,A15和A37所产木聚糖酶最适温度为55℃,在50-60℃之间能保持较高酶活。
3.7.2酶的最适pH测定
图 3-4 pH对木聚糖酶酶活的影响
(A: A15; B:A37)
结果表明,A15所产木聚糖酶最适反应pH为7,A37为6.5,在pH6-7.5之间两菌株均能保持较高的酶活性
第四章 结论与展望
4.1结论
随着木聚糖酶在工业上的应用越来越广泛,开发具有高催化效率、高酶活、耐高温和耐酸碱的新型木聚糖酶成为了现今研究的热门课题。本实验室结合分子生物学和基因工程,将厌氧真菌Neocallimastix patriciarum木聚糖酶基因克隆到毕赤酵母中,进一步提高了该酶的催化效率。实验结论如下:
(1)由于pPIC9K载体大小约为9300 bp,重组质粒pPIC9K-xynNP约为10320 bp。经线性化后通过电击转入毕赤酵母,通过MD培养基和PCR检测的方法筛选出阳性克隆子。
(2)木聚糖酶的SDS-PAGE凝胶电泳结果表明,在毕赤酵母中表达的木聚糖酶约为35 KDa。
(3)本实验所表达的木聚糖酶酶活力有了较大的提升,A15菌株的酶活达到了1180.5 U/ml, A37菌株则达到了1007.5 U/ml。经过离子交换柱纯化后酶活得到了进一步的提升。
(4)在不同的温度和pH下测酶活后发现,最适温度为55℃。最适pH方面A15为7.0,A37则为6.4。
4.2展望
(1)在传统石油能源价格飞涨以及环境保护呼声高涨的当下,开发利用更为环保的生物质能迫在眉睫。半纤维素是储量极为丰富的生物质能,属于可再生能源。随着现代科技的发展,半纤维素已经在各大领域都发挥了极其重要的作用,但是木聚糖酶生产纤维素成本高和生产率低是现代工业化生产的一大难题。因此研发具有高催化效率、耐高温和酸碱的新型木聚糖酶具有很大的现实意义。
(2)利用基因工程和分子生物学手段,在导入毕赤酵母之前对木聚糖酶基因进行基因层面的修饰,如基因编辑等,有利于提高木聚糖酶的表达量,优化理化性质。
参考文献
[1] A. Demirbas.Mechanisms of liquefaction and pyrolysis reactions of biomass Energy Conv Manage,2000,4:633-646.
[2] 张慧敏, 李剑芳, 邬敏辰,等. 耐热木聚糖酶基因在毕赤酵母中的表达及酶学性质[J]. 食品与生物技术学报, 2013, 32(2):124-128.




