年产1500万支阿昔洛韦滴耳液的生产车间设计开题报告
2020-02-10 23:07:48
1. 研究目的与意义(文献综述)
| 1.1研究背景及其意义 阿昔洛韦(9-[{2-羟基乙氧基}甲基]-9H-鸟嘌呤;Acyclovir;ACV; Zovirax)又名无环鸟苷,是脱氧鸟苷类似物,为一种高效广谱的抗病毒药。阿昔洛韦对单纯疱疹病毒1型(HSV-1)和单纯疱疹病毒2型(HSV-2)的效力大约为对水痘-带状疱疹病毒(VZV)的10倍,对抗巨细胞病毒(CMV)的活性较低。阿昔洛韦抑制生殖感染细胞中Epstein-Barr病毒(EBV)的复制,但不影响潜伏或持续感染。随着人们研究的深入,该类药物还可以应用于抗HIV病毒。当局部给药、肠胃外给药或口服给药时,阿昔洛韦在实验性HSV感染中显示出抗病毒活性。 阿昔洛韦(ACV)的抗病毒机制为进入感染细胞,被病毒编码的胸苷激酶(HSV-TK)选择性磷酸化为感染细胞中的单磷酸衍生物,然后被细胞的核苷激酶进一步转化为二磷酸-和三磷酸(TP)-活性衍生物(ACV-TP)。 ACV-TP形式是病毒DNA聚合酶的竞争性抑制剂,ACV-TP通过模拟核苷酸与病毒DNA聚合酶结合,混入病毒DNA并中止其延伸。 ACV对HSV-TK的亲和力是正常细胞胸苷激酶(TK)的约200倍,正常细胞无法使ACV磷酸化,故ACV显示出对HSV的高选择性和对正常细胞的低毒性。 内耳感染主要源自病毒性病因。巨细胞病毒(CMV)、单纯疱疹病毒(HSV)、水痘-带状疱疹病毒(VZV)为原发性内耳感染的感染因子,其表现可能包括听力损失或平衡困难。目前首先治疗方法为口服阿昔洛韦。 带状疱疹耳鸣(HZ oticus)是内耳、中耳和外耳的病毒感染,表现为严重的耳痛和耳部局部皮肤水疱疹,由面神经的齿状神经节中潜伏的水痘-带状疱疹病毒(VZV)的再激活引起。耳部带状疱疹的治疗通常采用阿昔洛韦和伐昔洛韦。 阿昔洛韦口服和全身用药存在一些毒副作用、与药物的相互作用,且生物利用度低。阿昔洛韦口服生物利用度仅15-30%,接受口服阿昔洛韦治疗的患者偶尔会出现恶心,腹泻,皮疹或头痛等不良反应。静脉注射阿昔洛韦治疗后,局部药物外渗后可能发生炎症和静脉炎。在通过快速静脉内输注大剂量阿昔洛韦后,已经观察到由肾中阿昔洛韦晶体积聚引起的肾功能障碍(包括急性肾衰竭病例),但通常是可逆的。 阿昔洛韦神经毒性与中枢神经系统(CNS)紊乱有关,表现为激动,幻觉,定向障碍,震颤,阵挛和癫痫发作。 核苷类抗疱疹病毒类药物随着随着基因治疗和RNA干扰技术的快速发展,近年来该类药物的研发非常活跃,与阿昔洛韦相比,下一代药物伐昔洛韦、泛昔洛韦口服生物利用度高,不良反应少。阿昔洛韦可开发新的局部用药剂型。 在用阿昔洛韦治疗耳部感染时,局部递送相对于全身递送具有许多优点。这些优点包括: 可以将更高浓度的抗病毒药递送到感染部位; 局部给药的药物相比于口服给药、全身给药等,没有全身作用; 局部递送允许改变局部微环境; 耳部局部药物通常比同类全身药物便宜。 |
阿昔洛韦已有滴眼液剂型,但作为生物药剂学分类系统(BCS) III类或IV类药物,具有低渗透性和高溶解度或极低溶解度和渗透性。
目前用于增加ACV溶解的各种方法,包括微粉化,纳米悬浮液,固体分散体,与环糊精的包合复合物,共结晶,微乳液制剂。在兔的ACV血浆浓度试验中,单剂量的ACV纯物质分别作为溶液和固体分散体,固体分散体显示出更高的AUC值(5倍)。羟丙甲纤维素(HPMC)可成功用作水溶性差的药物溶出率改善的载体,通过制备无水阿昔洛韦与羟丙甲纤维素的固体分散体,再溶于溶剂中制成滴耳液,来增加药物溶出速率。
|
1.2国内外研究现状分析 阿昔洛韦于1977年被发现。其发明者美国药理学家格特鲁德·B·埃利恩(Gertrude Belle Elion)也部分因此而获得1988年诺贝尔生理学或医学奖。阿昔洛韦也被列入世界卫生组织基本药物标准清单,是建立基础照护系统时,最重要的必备基础药物之一。 阿昔洛韦自1981年英国上市以来,它的合成方法和生产工艺研究一直受到人们的重视,至今已有多种合成方法,但普遍还存在以下问题:原料价格昂贵,用到有毒试剂,产品品质低、收率低,产品分离困难。 根据Lutker等人提出的ACV水合物形式的命名法,阿昔洛韦2/3水合物(形式V)和二水合物(形式VI)在大气条件下稳定,其中形式V为目前广泛商用。 阿昔洛韦于1981年上市,至今已有多个国家销售,有6种制剂,片剂、针剂、霜剂、眼膏、软膏及滴眼剂,是目前世界销售量最大的抗病毒药物。这不仅因为阿昔洛韦作为第三代抗疱疹病毒药物对疱疹病毒具有高度的选择性和抑制作用,而且其抗病毒活性比第二代阿糖腺苷强160倍,比第一代碘苷强10倍。 阿昔洛韦是由Actavis Elizabeth,Apotex Inc,Boscogen,Cadila Pharms Ltd,Carlsbad Technology,Chartwell Molecules,Dava Pharms Inc,Heritage Pharms Inc,Ivax Sub Teva Pharms,Lek Pharm,Mylan,Ranbaxy,Roxane销售的六种品牌药物中的通用成分。有五项专利保护这种化合物。 阿昔洛韦在25个国家拥有36个专利家族成员。阿昔洛韦有56个药物主文件条目。该化合物有75家供应商。三种初步批准。
|
2. 研究的基本内容与方案
| 2.1研究(设计)的基本内容 1、设计阿昔洛韦的生产工艺流程,确定阿昔洛韦滴耳液规格、处方。 2、对年产1500万支阿昔洛韦滴耳液的生产过程进行工艺衡算,包括物料衡算和热量衡算。 3、画出带控制点的工艺流程图(CAD制图)。 4、对阿昔洛韦生产设备进行工艺设计,确定设备的选型,画出主要设备的装配图(CAD制图)。 5、对车间的公用工程进行设计,包括水电气系统的设计,消防系统的设计等。 6、确定厂房布置、设备的布置、管道的布置,画出车间布置图(CAD制图)。
2.2研究(设计)的目标 完成年产1500万支阿昔洛韦滴耳液生产车间设计包括:物料衡算、能量衡算、设备选型、平面布置图、管线分布图、人流物流通道的布局以及“三废”治理等。
2.3拟采用的技术方案及措施 2.3.1 固体分散体制备 |
采用热熔挤出技术将阿昔洛韦熔于载体,改善原有阿昔洛韦液体制剂低温下析出结晶的缺陷。适用于对热稳定的药物和载体。
主药阿昔洛韦与载体羟丙甲纤维素在1:3配比制得的固体分散体质量较为稳定、均一、安全可靠。从加料器加阿昔洛韦和载体至微量混合流变仪,阿昔洛韦熔点为250℃,玻璃转变温度为190-200℃,将操作温度设定在药物的熔点附近,200℃。挤出时间为15分钟,条状挤出物性状为白色均一。
| 2.3.2 滴耳液处方 阿昔洛韦滴耳液规格为5ml:5mg。处方及用量如下:
|
处方依据:
渗透压调节剂:氯化钠。
抑菌剂:苯扎溴铵溶液(5%)
苯扎溴铵(新洁尔灭)对金属、塑料无腐蚀,耐热压灭菌。低浓度用作抑菌剂,改变细菌胞浆膜的通透性,使菌体物质外渗,阻断其代谢而起到杀灭作用,对革兰氏阳性细菌作用较强,对铜绿假单胞菌、抗酸杆菌无效。本品在耳鼻用药剂防腐剂浓度为0.002-0.02%,有时与0.002-0.005%硫柳汞合用。
Ph值调节剂:醋酸溶液(5%)
阿昔洛韦pKa值为2.19和9.28。
阿昔洛韦在酸性条件下溶解度增大。并且健康的耳道皮肤有酸性pH值,而外耳炎症患者外耳道pH值为5.5-7.8。耳道的再酸化可能有助于耳道再生进而有助于治疗外耳炎。
| 表2 阿昔洛韦平衡溶解度
|
| 健康的耳道呈酸性环境,感染者外耳ph为5.5-7.8。酸性环境有利于角质层的再生,促进感染部位的恢复。阿昔洛韦液体制剂目前有滴眼液和注射液,多采用氢氧化钠碱化呈碱性。阿昔洛韦水溶液呈弱碱性,在酸性溶液和水中溶解度更高,不再进一步碱化有利于感染部位恢复。 |
| 将阿昔洛韦固体分散体按处方比例折算后与氯化钠用70%注射用水慢慢搅拌溶解,加热至l00℃,保温半小时;将上述溶液冷却至40℃,加入苯扎溴铵溶液,搅拌均匀,用5%醋酸溶液调节pH至6.0;加注射用水至全量,药液经0.45μm粗滤和0.22μm精滤 过滤后灌装,即得。 2.3.3 生产工艺流程
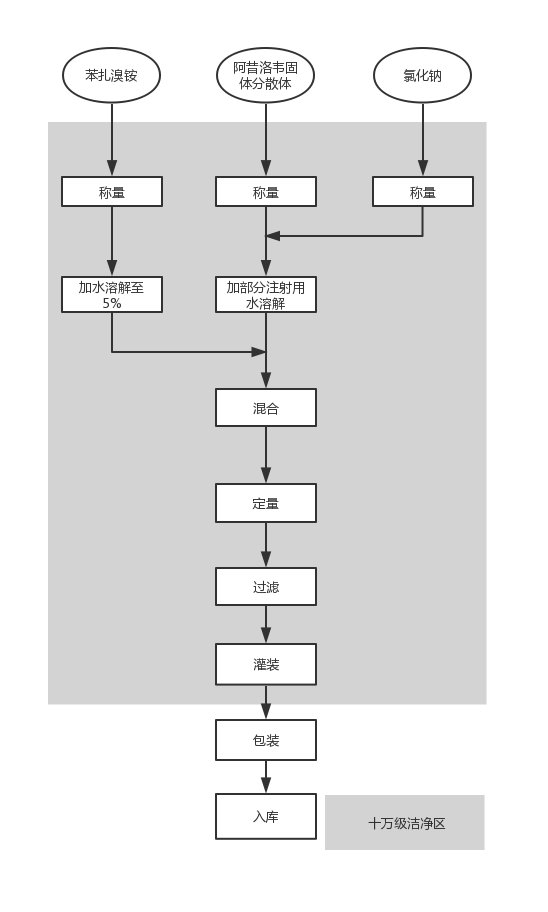
包装规格:5 ml×1瓶×10盒×40中包。 |
3. 研究计划与安排
第1-2周:查阅相关文献资料,进行现场调研,明确设计内容,完成开题报告。
第3-7周:根据生产工艺路线,进行“三算”,进行设备选型。
第8—10周:进行图纸绘制,提交老师修改。
4. 参考文献(12篇以上)
| [1] GnannJr., M. R. S. W. (2017). 153 - Drugs for HerpesvirusInfections. Infectious Diseases (Fourth Edition), Elsevier: 1309-1317.e1. [2] Aoki, F. Y. (2015). 45 - Antivirals against Herpes Viruses.Mandell, Douglas, and Bennett's Principles and Practice of InfectiousDiseases (Eighth Edition), Elsevier: 546-562.e7. [3] De Clercq, E. (2013). Anti-Viral Agents, San Diego, CA :Academic Press. [4] Jane Huey-Jiuan Li, V. H. and L. B. O. I. Jouhn-Wern Jang AqueousAcyclovir Product. US006136814A. [5] Christina Bloem, M. M. (2018). Herpes Zoster Oticus.Emergency Medicine. M. F. Steven C Dronen. [6] Arshi Munawwar, S. S. (2016). "Human Herpesviruses asCopathogens of HIV Infection, Their Role in HIV Transmission, and DiseaseProgression." Lab Physicians(8(1)): 5-18. [7] Chemaly, R. F. and J. A. Hill, et al. (2019). "Invitro comparison of currently available and investigational antiviral agentsagainst pathogenic human double-stranded DNA viruses: A systematic literaturereview." Antiviral Research 163: 50-58. [8] Musso M. F., C. J. D. (2016). Infections of the ExternalEar. Infectious Diseases in Pediatric Otolaryngology. V. J. E. In Valdez T.,Springer: 15-28. [9] MD, K. R. B. (2016). Ototopical Antibiotics. A. D. Meyers. [10] Organization, W. H. (2014). WHO Model List of EssentialMedicines. [11] Ashish Kumar Gupta, Minakshi Verma.(2016). PreformulationStudies of Acyclovir with Special Reference to Development of AnalyticalMethods, Crystal Properties of Drug and Drug-Excipients Interaction Studies.ASIO-JPHMR Volume 2,Issue 2,1-8 [12] N. Aravinda, Krishna Mohan Chinala. (2017). Solubility Enhancementof Acyclovir by Solid Dispersion Method. Research Gate. [13] 赖焜民 (2012). 阿昔洛韦的合成, 南昌大学: 25-28. [14] 李坚军与鞠金军等 (2012)."阿昔洛韦的合成工艺改进." 化工生产与技术 19 (02): 9-11 33 3. [15] 卫生部令第七十九号 (2010). 药品生产质量管理规范: 附录:无菌药品. [16] 谭梓骏与王国华等 (2018). 一种阿昔洛韦的制作工艺. 2018.11.16. CN 108822108 A. [17] 周宇与王盛等 (2012). 一种治疗单纯疱疹性角膜炎的抗病毒药及其制备方法. 2015.07.22 [18] . CN 103371971 B. [19] 《国家药品标准工作手册》(第三版) 国家药品标准(二部)正文各论编写细则(III)制剂标准编写细:178 [20] 国家药典委员会 (2015). 中华人民共和国药典:四部, 北京:化学工业出版社. 通则:24. |




