金鸡纳碱催化下基于动力学拆分的不对称P-C键构筑及应用研究毕业论文
2020-06-03 21:57:00
摘 要
开发了薄荷醇次磷酸酯/薄荷基苯基膦氧和烯丙基碳酸酯之间新不对称P-C键的形成反应。该方法不仅可以高产率,高的区域和非对映选择性生成各种功能化P*-C*立体异构磷化合物,而且通过动力学拆分获得(SP)-磷酸盐。
关键词:动力学拆分 不对称磷碳键的形成 区域和立体选择性
Study on Asymmetric P-C Bond Formation
Abstract
A novel catalytic asymmetric P-C bond formation between phosphinates/phosphine oxide and allylic carbonates was developed. This methodology not only could afford a variety of functionalized adjacent P,C-stereogenic phosphorus in high yields with high regio- and diastereoselectivities but also provide an alternative strategy to access enantiomerically enriched (SP)-phosphinates through kinetic resolution.
KeyWords:kinetic resolution;asymmetric P-C bond formation;regio- and diastereoselectivities
目录
摘要 I
Abstract I
第一章 文献综述 1
1.1引言 1
1.2传统P-C成键方法 1
1.2.1过渡金属催化 2
1.2.2无机盐催化P-C键的形成: 10
1.2.3有机小分子催化P-C键形成: 14
1.3本文研究的内容 17
第二章 金鸡纳碱催化下基于动力学拆分的不对称P-C键构筑及其用研究 18
2.1起始原料合成 18
2.1.1原料合成方法 18
2.1.2实验试剂 18
2.1.3实验仪器 19
2.2起始原料的制备 19
2.3研究思路 20
2.4实验内容 21
2.4.1条件优化 21
2.4.2底物拓展 23
2.4.3初探动力学拆分 25
2.4.4反应的应用 26
2.5 结果与讨论 27
表征数据及其代表性谱图 28
参考文献 50
致谢 53
第一章 文献综述
1.1引言
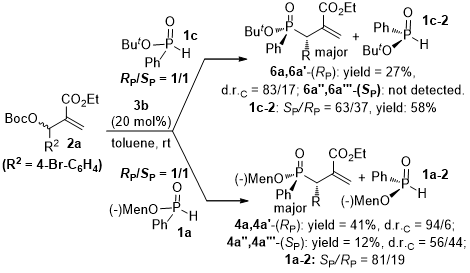
手性磷化合物在药物化学领域[1]和材料科学[2]中非常重要,通常被用作不对称催化中的重要配体[3]或有机催化剂[4]。通常,过渡金属[1a,5]或无机碱[6]促进不对称磷-碳键的合成构成了在磷或碳原子上具有手性中心的手性磷化合物[7]制备上的一些突出策略。近年来,从磷-氢化合物中的形成不对称磷-碳键受到越来越多的关注[8]。这一策略为多功能手性磷化合物的构建提供了多种有效和绿色的途径。迄今为止,这些研究致力于通过偶联手性磷-氢物种([R2PH] [9],[R2P(OH)] [10]和(RO)2P(O)H[11])和前手性碳原子来控制碳原子上的单个立体中心。例如,Wang[10c-d]和Shi[11b]独立研究了MBH碳酸酯与氧化膦或膦酸盐的有机催化烯丙基取代反应。据我们所知,通过控制产生新的磷-碳键末端碳的立体化学,并产生相邻的P-C-立体异构手性磷化合物几乎没有被报道,但是这种类型的反应在手性膦配体的合成中是非常有价值的[12]。2009年,Tan和他的同事开发了第一个手性胍盐催化的磷-曼尼希反应,获得消旋室的α-氨基磷酸酯和H-亚磷酸酯[13]。我们被将手性化合物与前手性化合物偶合或通过偶联两个外消旋体,继而在磷和碳中心产生具有丰富立体化学的手性磷化合物的方法所吸引
1.2传统P-C成键方法
根据连在P(O)OR的原子基团(碳原子,羟基,或者两者都有)的不同,存在着三种膦酸酯:(1)磷酸酯(2)H-磷酸酯(3)二取代的次膦酸酯
当至少连有一个氢时,亚膦酰基P(O)H存在互变异构P-OH(图1)。
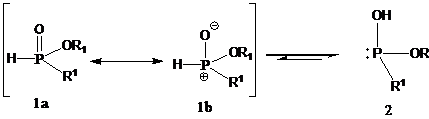
图1:亚膦酰基的互变异构
值得注意的是,然常规的表示法P=O 1a仍然普遍存在,但是鏻阳离子共振形式1b是更好和更有用的表示。
次磷酸酯1(R1 = H)通常比H-次膦酸酯(R1 = Alk)反应性更高,因为在图1中,给电子R1基团使互变异构化不利。另一方面,吸电子取代基有助于稳定2。对于大多数化合物,平衡总是在1的一侧,但是小的电子差异显着影响这个平衡,而R1 =芳基使2的可用性更高。
1.2.1过渡金属催化
金属偶联:
Schwabacher和Holt早些时候报道了次磷酸盐的钯催化交叉偶联。在这个过程中,磷化合物与其他交叉耦合过程一样充当亲核试剂。但他们的方法适用范围相对较窄,由于次磷酸酯的还原能力强,转移氢化是一个重要的副反应。
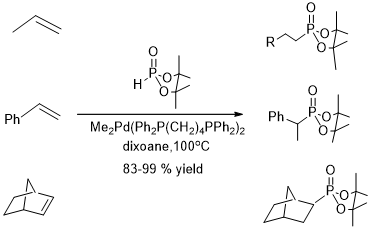
J.-L. Montchamp[1]报道了一种适用性较强的交叉偶联反应(图2),反应使用2mol%或更少的钯和简单配体(PPh3,dppp,dppf或xantphos),溶剂如乙二醇(EG)或1,2-二甲氧基乙烷(DME)对反应的影响较小。
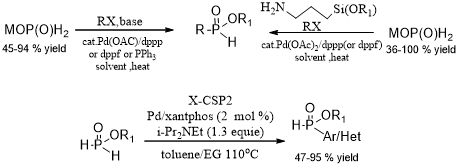
相关图片展示: