两种B-Box结构域蛋白BBX18和BBX23与ELF3相互作用并调节拟南芥中的热形态发生外文翻译资料
2023-03-28 11:51:25
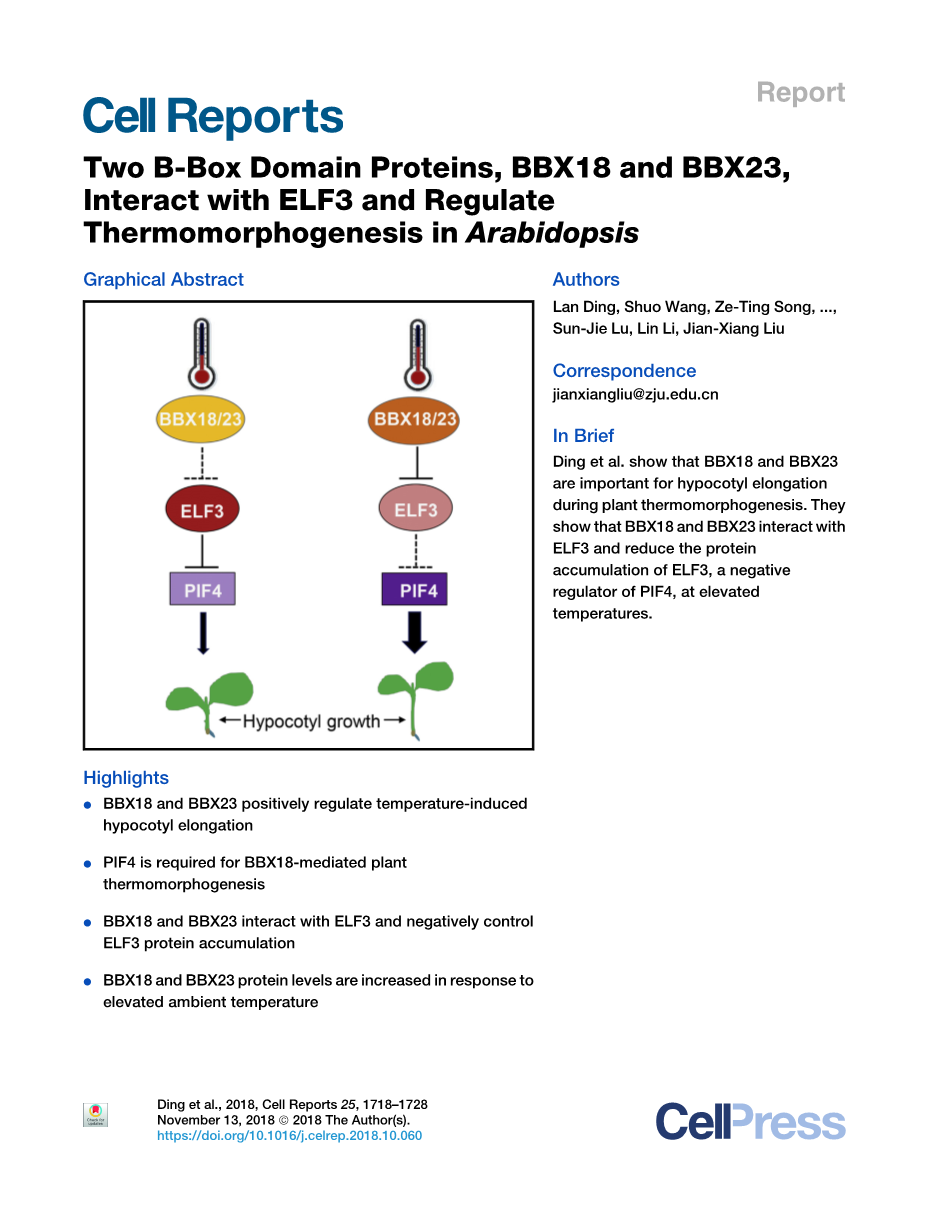
两种B-Box结构域蛋白BBX18和BBX23与ELF3相互作用并调节拟南芥中的热形态发生
作者:Lan Ding,1,2 Shuo Wang,1 Ze-Ting Song,1,2 Yupei Jiang,1 Jia-Jia Han,1,2 Sun-Jie Lu,1 Lin Li,1 and Jian-Xiang Liu1,2,3,*
单位:1State Key Laboratory of Genetic Engineering, School of Life Sciences, Fudan University, Shanghai 200433, China
2State Key Laboratory of Plant Physiology and Biochemistry, College of Life Sciences, Zhejiang University, Hangzhou 310027, China
3Lead Contact
摘要:植物的生长和发育过程与各种内源信号和环境挑战相协调。光敏色素互作因子 4(PIF4)在拟南芥的热响应基因表达和下胚轴生长中起着重要的积极作用,而early flowering 3(ELF3)在高温下负向调控PIF4的活性。然而,在温暖条件下,ELF3的活动是如何调节的还不清楚。在这里,我们报告鉴定B-box 18(BBX18)和BBX23作为拟南芥中重要的热形态发生调控因子。BBX18和BBX23突变导致热响应性下胚轴伸长减少。相反,高温条件下BBX18过表达促进下胚轴的生长,这取决于PIF4或 constitutive photomphogenic 1(COP1)。BBX18和BBX23与ELF3或COP1相互作用。在正常和温暖条件下,敲除BBX18和BBX23会增加ELF3丰度。在PIF4突变体和BBX18/BBX23双突变体中,多个热响应基因的表达均受损。因此,我们的发现揭示了B-box蛋白在热形态发生过程中的重要作用,并为我们理解温暖温度信号如何调节ELF3活性和PIF4依赖基因提供了见解。
关键词:B-box;BBX28;BBX23;COP1;ELF3;PIF4;热形态发生
引言
作为固着生物,植物的生长和发育必须与各种内源信号和环境挑战相协调,包括昼夜和季节性的温度波动。在模型植物拟南芥中,升高的环境温度诱导下胚轴和叶柄快速伸长,并加速开花,这可能使叶片与土壤和彼此充分分离,以便更好地生长和更快地完成生命周期(Legris et al., 2017; Quint et al., 2016)。植物热形态发生研究的重大突破是光敏色素互作因子4(PIF4)被鉴定为热形态发生变化的关键调控因子,包括下胚轴和叶柄的伸长(Franklin et al., 2011; Koini et al., 2009; Kumar et al., 2012; Proveniers and van Zanten, 2013; Sun et al., 2012)。PIF4的表达和PIF4的活性都受到高温的协调调控,确保在对生物量和产量几乎不受影响的条件下更快地生长(Quint et al., 2016)。PIF4最初被鉴定为光敏色素B (phyB)互作蛋白(de Lucas and Prat, 2014; Huq and Quail, 2002; Ni et al., 1998)。最近报道了红光受体phyB在温度传感中的作用(Jung et al., 2016),但在高温条件下,phyB与PIF4之间的联系尚未完全清楚。
phyB信号转导下游温度和光调控下胚轴伸长的另一个分支涉及 constitutive photomphogenic 1(COP1)和extended hypocoty5(HY5)。HY5是一种bZIP转录因子,通过竞争性染色质结合PIF4靶标,在热形态发生过程中抑制下胚轴伸长(Gangappa and Kumar, 2017)。在黑暗或高温下,HY5被泛素环E3连接酶COP1降解,释放出HY5对下胚轴生长的抑制作用(Delker et al., 2014; Gangappa and Kumar, 2017; Osterlund et al., 2000; Park et al., 2017)。然而,高温如何调节COP1的入核尚不清楚。
- box(BBX)家族蛋白是锌指蛋白,包含一个或两个BBX基序,偶尔在C端有一个CONSTANS、CONSTANS-like (CO-like)和TOC1 (CCT)结构域(Khanna et al., 2009)。拟南芥中存在32个BBX蛋白;这些蛋白质根据其结构域分为五个亚组。CCT结构域参与转录调控或入核,仅存在于I组—III组BBX蛋白中(Gangappa and Botto, 2014)。BBX基序在转录调控和蛋白-蛋白互作中很重要 (Gangappa and Botto, 2014; Khanna et al., 2009)。I、II和IV组BBX蛋白有两个BBX基序,而III和V组BBX蛋白只有一个BBX基序(Khanna et al., 2009)。BBX蛋白主要参与幼苗的光形态建成、花的光周期调控、避阴以及对生物和非生物胁迫的响应(Gangappa and Botto, 2014)。然而,BBX蛋白在植物热形态发生中的作用尚未见报道。
在本研究中,我们证明了IV组BBX蛋白BBX18和BBX23是参与植物热形态发生的重要正向调控因子。我们的遗传实验结果表明BBX18和BBX23在PIF4的上游。我们发现,BBX18和BBX23分别与early flowering 3(ELF3)和COP1互作,并且在正常和温暖条件下,BBX18和BBX23的突变都会影响ELF3蛋白的丰度。此外,一个依赖于pif4的热响应基因亚群也受BBX18和BBX23的控制,突出了BBX18和BBX23在植物热形态发生中的重要性。
结果
拟南芥BBX18和BBX23在蛋白质水平上都受到温度升高的调控
为了了解BBX基因在植物热形态发生中的可能生物学意义,我们通过qRT-PCR研究了在环境温度升高条件下拟南芥BBX家族IV组成员的表达模式。从BBX18到BBX25的8个BBX基因中,与22 ℃下的结果相比,在29 ℃条件下,BBX18和BBX25的表达显著上调(fold induction gt; 2, p lt; 0.01)而BBX22和BBX24的表达则显著下调(1 gt; fold induction gt; 0.5, p lt; 0.05)(图1A)。考虑到在BBX家族内形成异源二聚体的目的(Gangappa and Botto, 2014),我们研究了拟南芥BBX家族IV组成员之间可能存在的蛋白互作。酵母双杂交试验表明,BBX18与BBX19、BBX23和自身互作(图S1A)。BBX18和BBX23的互作在烟草叶片的体外拉下实验和体内荧光素酶裂解实验中得到了进一步证实(Figures S1B and S1C)。之前的研究结果表明,BBX19和BBX25调控幼苗的去黄化,在光照条件下,BBX25功能缺失突变体的下胚轴明显短于野生型幼苗(Gangappa et al., 2013; Wang et al., 2015)。因此,本文重点研究了BBX18和BBX23的表征。我们感兴趣的是BBX18和BBX23在蛋白质水平上是否受到温暖温度的调控。因此,我们构建了由组成型花椰菜花叶病毒(CaMV)35S启动子驱动的BBX18和BBX23过表达植株。除了BBX18和BBX23的昼夜节律调节外,在温度升高条件下还观察到BBX18和BBX23蛋白的更多积累(图1B和1C)。因此,BBX18和BBX23的蛋白水平随着环境温度的升高而上调。
图1. 拟南芥BBX18和BBX23是热形态发生的正向调控因子
(A)环境温度升高对BBX18和BBX25的上调。将22℃生长的7日龄野生型拟南芥(WT)幼苗移栽到22℃或29℃中3-9小时后,用qRT-PCR检测IV组BBX基因的表达。折叠诱导是每个基因在29℃处的表达水平归一化到22℃处的表达水平,两者归一化到PP2A。误差线表示SE(n = 3)。** p lt; 0.01;* p lt; 0.05;# p = 0.05,t-test不显著。
(B和C) BBX18和BBX23蛋白水平对环境温度升高的响应增加。在拟南芥中表达了CaMV 35S启动子的BBX18-FLAG(B)和BBX23-FLAG(C)融合蛋白。将生长在22℃的7天的转基因幼苗转移到22℃或29℃中3-9小时,然后用抗flag抗体的western blotting检测融合蛋白。微管蛋白作为蛋白质装载控制。每个波段的信号强度被量化并归一化为第一个样本的信号强度。
(D和E)高温下BBX18或BBX23功能缺失突变体的短下胚轴表型。
(F和G)高温下BBX18过表达植株的长胚轴表型与CaMV 35S启动子组成BBX18-FLAG和BBX23-FLAG融合蛋白在拟南芥中过表达。
将生长在22 ℃的野生型(WT) ,BBX18 / BBX23单突变体或双突变体,PIF4突变体(pif4 - 101),和BBX18ox BBX23ox转基因4日龄幼苗移栽到22 ℃或29 ℃条件下4天,然后对代表植物成像,测量每个植物的下胚轴长度。进行3次生物重复,每个重复测量8株植株。条形图描述了SE (n = 3)。条形图上方的字母表示Duncans多量程检验(p lt; 0.01)。
拟南芥BBX18和BBX23是重要的热形态发生正向调控因子
为了了解BBX18和BBX23在植物热形态发生中的生物学功能,我们构建了几个BBX18和BBX23的单突变株和双突变株(Figures S2A and S2B; Yan et al., 2015)。这些突变体和野生型一样在正常生长温度条件下生长正常(图1D)。然而,与野生型幼苗相比,温暖条件诱导下胚轴伸长在BBX18和BBX23单突变体幼苗中均显著减少,在BBX18/BBX23双突变体幼苗中进一步减少(图1D和1E)。在BBX18/BBX23双突变体中,热响应的下胚轴伸长并没有完全被消除,这表明BBX家族的其他成员可能也参与了热形态发生调控。我们还比较了BBX18和BBX23过表达植株与野生型植株的下胚轴表型。在22 ℃下,BBX18和BBX23过表达植株的下胚轴长度与野生型植株相似(图1F和1G)。当温度升高(29 ℃)时,BBX18过表达植株的下胚轴比野生型植株延长,而BBX23过表达植株的下胚轴没有延长(图1F和1G)。western blot检测显示BBX23确实过表达(图S2C)。BBX23过表达植株缺乏可见的热形态发生表型可能是由于需要其他因子与BBX23形成复合体来调控热形态发生。为了了解BBX18和BBX23是否参与暗形态建成,我们将野生型、BBX18/BBX23双突变体、BBX18和BBX23过表达的植株在22℃的黑暗环境中萌发,这些植株材料之间没有显著差异(图S3)。然而,这些结果表明,BBX18和BBX23都协同调控拟南芥的热形态发生。
图2. BBX18介导的热形态发生需要PIF4
(A和B)PIF4在温度调节的下胚轴伸长中与BBX18和BBX23是上位性的。将bbx18-2 bbx23-2双突变体与pif4-101杂交得到bbx18-2 bbx23-2
剩余内容已隐藏,支付完成后下载完整资料

英语原文共 12 页,剩余内容已隐藏,支付完成后下载完整资料
资料编号:[597786],资料为PDF文档或Word文档,PDF文档可免费转换为Word




