用BioID鉴定培养细胞和移植瘤中新型c-MYC相互作用的蛋白外文翻译资料
2023-01-28 11:48:32

英语原文共 17 页,剩余内容已隐藏,支付完成后下载完整资料
用BioID鉴定培养细胞和移植瘤中新型c-MYC相互作用的蛋白
关键词:BioID CHD8 c-MYC致癌基因 质谱 蛋白组学
摘要:
BioID这个接近型生物素标记技术最近用于表征蛋白和蛋白之间相互作用网络,迄今为止,该方法已被应用于培养细胞中大量不同多肽的表达。这篇文章中我们论述了BioID对人体细胞中c-MYC致癌基因周围相互作用蛋白的鉴定在标准培养条件和在小鼠体内作为移植癌生长的适应。值得注意的是,在体内BioID产生大于100个高信度MYC相互作用蛋白,包括大于30个已知的结合配体。新型MYC相互作用子包括STAGA / KAT5和SWI / SNF染色质重塑复合物的成分,DNA修复和复制因素、一般转录和延伸因子以及转录共调节因子如DNA解旋酶蛋白染色体8(CHD8)。这些发现给了我们很大的信心,ENCODE ChIP-seq数据集中显示出MYC相互作用子在整个基因组鉴定中很巧合的连接在一起,并且我们使用酵母双杂交分析和基于邻近的连接测定来验证以前未知的MYC-CHD8相互作用。总的来说,我们证明BioID可用于识别体内染色质相关蛋白的真正相互作用的配体。这个技术可以提高我们对蛋白质之间相互作用的理解,因为在这之前还没有方法能解决这个问题。
生物学意义
c-MYC致癌基因是一种转录因子,在癌症起始和进展中起重要作用。MYC在超过50%的人类癌症中被反常表达,但是这种蛋白质在正常细胞生物学和肿瘤进展中的作用尚未得到很好的理解,部分原因在于识别MYC相互作用的蛋白质在技术上是具有挑战性的:使用传统的亲和纯化方法难以分离含MYC的染色质相关复合物,MYC蛋白质异常不稳定,半衰期仅为30分钟。开发一个新的策略获得对含有MYC蛋白复合物的了解将会在癌症研究中带来关键性的促进作用。
最近描述的BioID基于邻近的标记技术在培养细胞中蛋白和蛋白相互作用的性质方面展示了一个新的有前途的互补方法。这篇文章中所说的BioID也可以用来表现移植瘤中相关染色质蛋白的蛋白和蛋白相互作用,并且在体内呈现一个综合的高可信度的MYC相互作用体。
本文是题为:蛋白质在健康和疾病方面的动态特刊的一部分。
客座编辑:Pierre Thibault和Anne-Claude Gingras。
1.介绍
通过标准亲和纯化和质谱分析法的结合 (AP-MS) ,将目的蛋白(最常见的是和标签蛋白如Flag,HA或TAP融合)用特异性抗体(或其他亲和试剂,表1)从细胞裂解物中分离出来。轻度洗涤后,标记的蛋白质及其结合配体从固相载体中洗脱出来然后进行质谱分析。
由于AP-MS依赖在整个裂解和纯化过程中蛋白质 - 蛋白质相互作用的稳定,所以细胞必须在轻度,非变性条件下裂解和洗涤。
质
谱
分
析
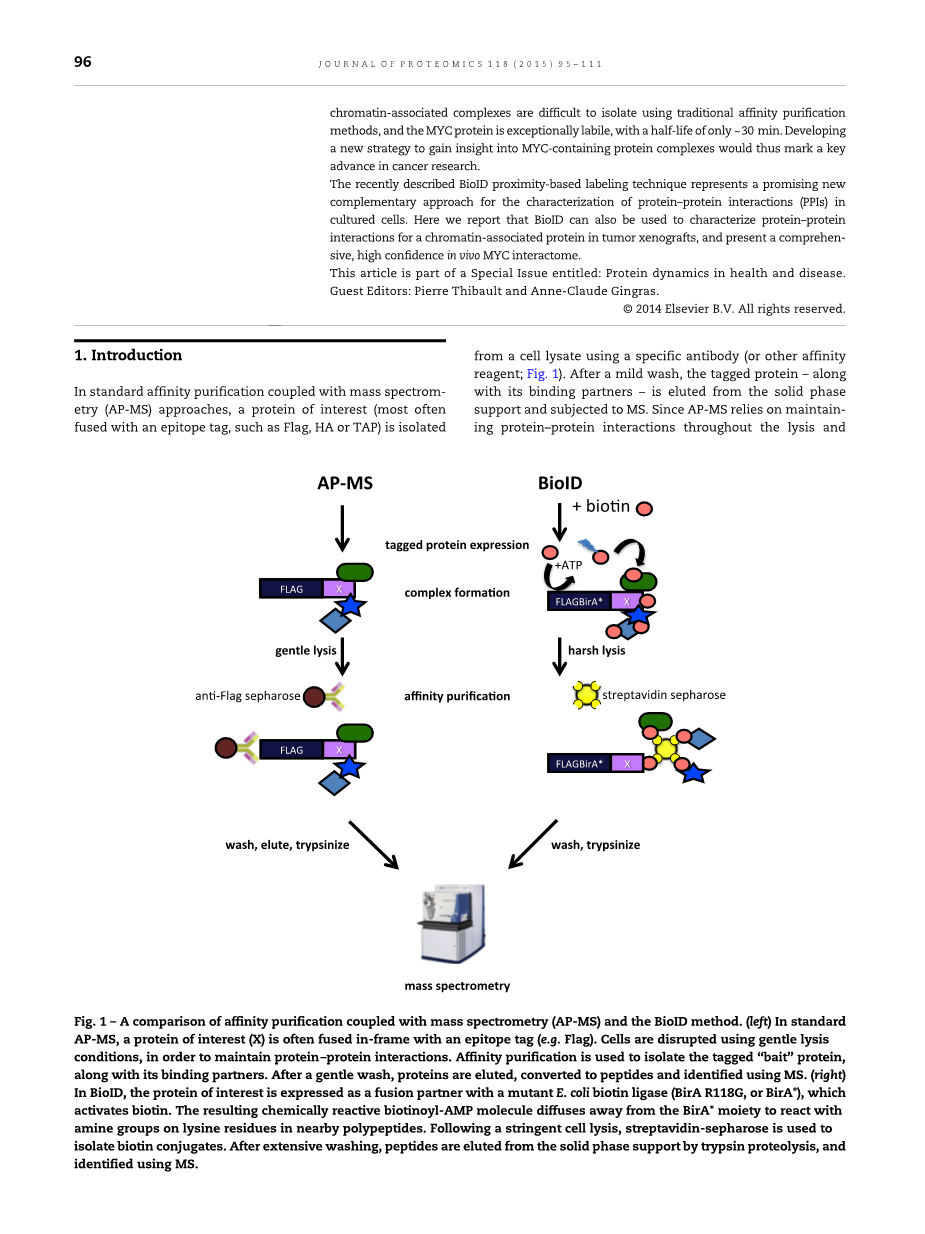
表1.亲和纯化与质谱结合(AP-MS)和BioID方法的比较。(左)在标准AP-MS中,目的蛋白质(X)通常与标签蛋白(例如Flag)融合。使用温和的裂解条件破坏细胞,以保持蛋白质 - 蛋白质相互作用。亲和纯化用于分离标记的“诱饵”蛋白及其结合配体。温和洗涤后,蛋白质被洗脱,转化成肽并用质谱分析鉴定。(右)在BioID中,目的蛋白质表达为与突变的大肠杆菌生物素连接酶(BirA R118G或BirA *)的融合配体,也是其活化生物素。所得到的化学反应性生物素基AMP分子扩散离开BirA *部分,和邻近多肽的赖氨酸残基上的胺基反应。经严格的细胞裂解后,使用链霉抗生物素蛋白琼脂糖分离生物素缀合物。 经大量洗涤后,肽通过胰蛋白酶蛋白酶解从固相支持物洗脱,并用质谱分析鉴定。
最近描述的BioID基于邻近的标记技术代表了描述蛋白质 - 蛋白质相互作用的有前景的新的补充方法。在BioID方法中,目的蛋白质表达为突变体大肠杆菌生物素连接酶(BirA R118G或BirA *)的融合配体。BirA *有效活化生物素,但对活化分子的亲和力降低。因此,化学反应性生物素基AMP简单地扩散离开BirA *部分,并与邻近的任何可用的胺基团反应 - 包括存在于附近多肽中的赖氨酸残基上的那些胺基团。经过严格的细胞裂解后,链霉抗生物素蛋白 - 琼脂糖可用于有效分离生物素复合物。经大量洗涤后,肽从固相支持物洗脱并用MS鉴定。Roux等人 首先通过鉴定293细胞中人类lamin A蛋白的相互作用的配偶体,最先证明了这种方法的可行性。其他研究最近已经使用BioID来鉴定Try-panosome蛋白的相互作用,涉及人类河马通路信号的多肽,紧密连接,粘着连接和人类中心相关蛋白。
c-MYC(MYC)致癌基因在超过50%的人类癌症中被放松管制。 然而,这种蛋白质在正常细胞生物学和肿瘤进展中的作用仍然不太清楚,部分原因是MYC相互作用的表达相对较差。 MYC蛋白质异常不稳定(半衰期仅为30分钟),大部分MYC与染色质紧密相关,使用标准AP-MS鉴定综合MYC相互作用的方法在技术上具有挑战性。 因此,开发一种新的策略,以了解含MYC的蛋白质复合物,将成为癌症研究的重要进展。
已经使用二维培养系统来描述细胞生物学的许多重要方面,但是现在已经清楚的是三维细胞组织,其它细胞类型的细胞间通讯,细胞外基质组成以及细胞微环境的其它方面显著影响细胞的行为和功能。 因此,在体内三维体系如异种移植物中评估质子泵抑制剂的方便方法也将是非常有用的。
BioID已经被证明是用于描述质子泵抑制剂的有希望的方法,但是迄今为止,它仅被应用于在培养细胞中相对少量多肽的表达。 在这里,我们所研究的BioID还可用于描述肿瘤异种移植物中染色质相关蛋白的蛋白质 - 蛋白质相互作用,并提供第一个综合的,高信度的基于生物体的体内MYC相互作用体。
- 材料和方法
2.1 克隆
使用含有AscI和NotI限制酶位点的引物PCR扩增编码MYC蛋白质(P01106)的人MYC cDNA(NCBI基因ID 4609)(AAAAAAGGCGCGCCTATGCCCCTCAACGTTAGC 和AAAAAAGCGGCCGCTTACGCA CAAGAGTTCCG), 并克隆到我们之前所说的pcDNA5 Flag-BirA *载体。
2.2 体内BioID
将200万个Flag-BirA * 293T-REx细胞或Flag-BirA * -MYC 293 T-REx细胞按照 加拿大动物保护委员会的准则注射到小鼠的左侧和右侧(6-8周龄的NOD-SCID雄性小鼠)。 在饮用水中以四环素盐酸盐(Sigma)诱导MYC融合蛋白表达(2g / l,从第1天开始)直到实验结束。 用卡尺测量肿瘤大小,等达到大约800mm 3(细胞注射后大约8周),在小鼠腹膜内注射30mu;g生物素(0.15mg / ml在PBS中),每天一次,持续两天。 第三天,用异氟烷麻醉小鼠,处死,移除异种移植物并迅速冷冻。将冷冻的异种移植物用研钵和研杵粉碎,将粉末重新悬浮于冷的改良的RIPA缓冲液(1%NP-40,0.5%脱氧胆酸钠,50mM Tris-HCl pH7.5,150mM NaCl,1mM EDTA,1 mM EGTA,0.1%SDS,1:500蛋白酶抑制剂混合物(Sigma)),以1:5的比例,溶解在均质组织匀浆器(Kontes)中,并与250U苯甲酸酶核酸酶(EMD)一起在 4°C孵育1小时。 将溶液超声处理3times;30秒(Fisher Scientific D100声速除菌仪,输出功率7W),并在4℃以27,000times;离心30分钟。 将得到的上清液与30mu;l(RIPA平衡)链霉抗生物素蛋白 - 琼脂糖凝胶珠(GE)在4℃末端旋转2小时孵育。 在胰蛋白酶消化之前,将珠子用7times;1ml 50mM硫酸铵铵(pH8.0)洗涤。
2.3 在培养细胞中的BioID
用1mu;g/ ml四环素和50mu;M生物素处理Flag-BirA *或Flag-BirA * -MYC 293T-REx细胞(约60%融合)分别诱导转基因表达和生物素标记24小时。 将细胞刮到PBS中,合并,在25ml PBS中洗涤两次,并在4℃下以1000times;g离心5分钟后收集。 将细胞沉淀在5ml冷的改良的RIPA缓冲液中裂解。 加入250U苯甲酸酶(EMD),分离如上所述的生物素化蛋白质。
2.4 质谱
将溶解在70mu;l50mM碳酸氢铵(pH8.3)中的1微克MS级TPCK胰蛋白酶(Promega,Madison,WI)加入到链霉抗生物素蛋白 - 琼脂糖珠中,并在37℃下孵育过夜。 收集洗脱液,珠子在100mu;l50mM碳酸氢铵中洗涤两次。 将合并的洗脱液冻干,然后重悬于0.1%甲酸中。 使用InnovaQuartz(Phoenix,AZ)的熔融石英毛细管内部制造的LC分析柱(内径75mu;m)和预柱(150mu;m内径)并填充100Aring;C18涂层二氧化硅颗粒(Magic,Michrom Bioresources,Auburn,CA)。对肽进行nanoLC-ESI-MS / MS,使用Proxeon EASY-nLC泵根据混合线性四极离子阱 (Velos LTQ)的轨道质谱仪 (Thermo Fisher Scientific, Waltham, MA)
反相(10-30%乙腈,0.1%甲酸)缓冲液梯度以250nl / min运行95分钟。在Orbitrap中使用60,000的分辨率进行母离子扫描。同时,选择最多二十个最强峰使用标准CID碎裂,用于MS / MS(用于激活的最小离子计数为1000)。在LTQ中检测片段离子。激活动态排除,在30秒的分析过程中使得MS / MS中相同的m / z(在10ppm窗口内的排除列表大小500)在15秒内检测到并排除。
对于蛋白质鉴定,使用Proteowizard 将Thermo.RAW文件转换为.mzXML格式,然后使用Mascot和Comet搜索引擎搜索人类RefSeq版本45(附加基于Refseq v45的反向诱饵数据库)。搜索参数指定了15 ppm的亲本MS耐受性和0.4 Da的MS / MS片段离子耐受性,最多允许有两个胰蛋白酶的缺失裂解。允许甲硫氨酸的氧化作为可变的修饰。使用至少两个技术重复分析每个异种移植物。使用iProphet作为跨蛋白质组管道的一部分,对肽和蛋白质鉴定进行统计验证。对于每个搜索,使用1%错误率的iProphet概率作为截断值来生成SAINT兼容的输入文件。 SAINT参数如下:重复5000次,低模式关闭,minFold 1和正常化。所有原始文件均可在UCSD Massive网站下载。项目名称:Dingar_in_vivo-BioID_ P103_VS6,ftp://MSV000078518.massive.ucsd.edu
2.5 免疫沉淀和免疫印迹分析
细胞裂解物与2mu;gIgG(sc-2027,Santa Cruz Biotechnology)或MAX抗体(sc-765,Santa Cruz Biotech-nology)4℃孵育过夜。 第二天,加入15mu;蛋白质G-sepharose珠(GE Healthcare),裂解物在4℃下进行末端转动4小时。 最后,将珠粒沉淀(425times;g,2分钟),用裂解缓冲液洗涤3次,重悬于2times;SDS样品缓冲液中,加热至95℃5分钟。 经短暂离心后,将样品进行10%SDS-PAGE,并转移到硝酸纤维素膜上。 蛋白质印迹见参考文献[19]。
2.6 免疫荧光显微镜
稳定的T-REx细胞表达标记蛋白在聚-L-赖氨酸(Sigma)涂覆的盖玻片上生长,用4%甲醛固定15分钟,并在含有0.25%Triton X-100的PBS中洗涤。 将细胞在PBS中的5%牛血清白蛋白(BSA)中封闭30分钟,然后在PBS 1:1000抗FLAG M2(Sigma)一抗中孵育1小时。 在1:1000和1:5000分别使用次级抗小鼠Alexa 488和Streptavidin-Alexa 594(Life Technologies),并在室温下孵育1小时。除去溶液后,将细胞与1mu;g/ ml 4,6-二亚氨基-2-苯基吲哚(DAPI)在PBS中一起孵育5分钟。 将盖片用PBS洗涤三次,每次5分钟,并用ProLong Gold Antifade(Thermo Fischer Scientific)装载。 在Olympus FV1000共聚焦显微镜(缩放因子介于3和5之间; Olympus America,Melville,NY)上,使用PlanApo 60times;油镜片NA 1.40对细胞成像。 使用Volocity Viewer v.6处理图像,并使用Adobe Illustrator CS5(Adobe Systems Inc.)进行组装。
2.7 网络分析
交互数据从STRING数据库v.9.1 [20]下载,并使用Cytoscape软件v.3.0.1 [21]进行修改。 以前识别的MYC交互器的分配基于BioGRID3.2数据库中的注释[22]。 为了简单起见,未显示不同蛋白质复合物和未连接的蛋白质节点之间的相互作用。
2.8 GSC分析
所有ChIP-seq转录因子结合位点被ENCODE[23]映射到K562细胞中,使用BEDTools [24]合并。 分析MYC结合位点与BioID在此识别的高置信MYC相互作用蛋白质的一致性结合,使用基因组结构测定(GSC)测试[25]。 在Z评分gt; 2.9913(Bonferroni校正)下确定alpha;= 0.05的统计学显着性。 以前确定为与MYC的共事件结合非统计学显着的三个转录因子被包括在分析中作为阴性对照。
2.9 邻近连接试验
将总共1
剩余内容已隐藏,支付完成后下载完整资料


英语原文共 17 页,剩余内容已隐藏,支付完成后下载完整资料
用BioID鉴定培养细胞和移植瘤中新型c-MYC相互作用的蛋白
关键词:BioID CHD8 c-MYC致癌基因 质谱 蛋白组学
摘要:
BioID这个接近型生物素标记技术最近用于表征蛋白和蛋白之间相互作用网络,迄今为止,该方法已被应用于培养细胞中大量不同多肽的表达。这篇文章中我们论述了BioID对人体细胞中c-MYC致癌基因周围相互作用蛋白的鉴定在标准培养条件和在小鼠体内作为移植癌生长的适应。值得注意的是,在体内BioID产生大于100个高信度MYC相互作用蛋白,包括大于30个已知的结合配体。新型MYC相互作用子包括STAGA / KAT5和SWI / SNF染色质重塑复合物的成分,DNA修复和复制因素、一般转录和延伸因子以及转录共调节因子如DNA解旋酶蛋白染色体8(CHD8)。这些发现给了我们很大的信心,ENCODE ChIP-seq数据集中显示出MYC相互作用子在整个基因组鉴定中很巧合的连接在一起,并且我们使用酵母双杂交分析和基于邻近的连接测定来验证以前未知的MYC-CHD8相互作用。总的来说,我们证明BioID可用于识别体内染色质相关蛋白的真正相互作用的配体。这个技术可以提高我们对蛋白质之间相互作用的理解,因为在这之前还没有方法能解决这个问题。
生物学意义
c-MYC致癌基因是一种转录因子,在癌症起始和进展中起重要作用。MYC在超过50%的人类癌症中被反常表达,但是这种蛋白质在正常细胞生物学和肿瘤进展中的作用尚未得到很好的理解,部分原因在于识别MYC相互作用的蛋白质在技术上是具有挑战性的:使用传统的亲和纯化方法难以分离含MYC的染色质相关复合物,MYC蛋白质异常不稳定,半衰期仅为30分钟。开发一个新的策略获得对含有MYC蛋白复合物的了解将会在癌症研究中带来关键性的促进作用。
最近描述的BioID基于邻近的标记技术在培养细胞中蛋白和蛋白相互作用的性质方面展示了一个新的有前途的互补方法。这篇文章中所说的BioID也可以用来表现移植瘤中相关染色质蛋白的蛋白和蛋白相互作用,并且在体内呈现一个综合的高可信度的MYC相互作用体。
本文是题为:蛋白质在健康和疾病方面的动态特刊的一部分。
客座编辑:Pierre Thibault和Anne-Claude Gingras。
1.介绍
通过标准亲和纯化和质谱分析法的结合 (AP-MS) ,将目的蛋白(最常见的是和标签蛋白如Flag,HA或TAP融合)用特异性抗体(或其他亲和试剂,表1)从细胞裂解物中分离出来。轻度洗涤后,标记的蛋白质及其结合配体从固相载体中洗脱出来然后进行质谱分析。
由于AP-MS依赖在整个裂解和纯化过程中蛋白质 - 蛋白质相互作用的稳定,所以细胞必须在轻度,非变性条件下裂解和洗涤。
质
谱
分
析
表1.亲和纯化与质谱结合(AP-MS)和BioID方法的比较。(左)在标准AP-MS中,目的蛋白质(X)通常与标签蛋白(例如Flag)融合。使用温和的裂解条件破坏细胞,以保持蛋白质 - 蛋白质相互作用。亲和纯化用于分离标记的“诱饵”蛋白及其结合配体。温和洗涤后,蛋白质被洗脱,转化成肽并用质谱分析鉴定。(右)在BioID中,目的蛋白质表达为与突变的大肠杆菌生物素连接酶(BirA R118G或BirA *)的融合配体,也是其活化生物素。所得到的化学反应性生物素基AMP分子扩散离开BirA *部分,和邻近多肽的赖氨酸残基上的胺基反应。经严格的细胞裂解后,使用链霉抗生物素蛋白琼脂糖分离生物素缀合物。 经大量洗涤后,肽通过胰蛋白酶蛋白酶解从固相支持物洗脱,并用质谱分析鉴定。
最近描述的BioID基于邻近的标记技术代表了描述蛋白质 - 蛋白质相互作用的有前景的新的补充方法。在BioID方法中,目的蛋白质表达为突变体大肠杆菌生物素连接酶(BirA R118G或BirA *)的融合配体。BirA *有效活化生物素,但对活化分子的亲和力降低。因此,化学反应性生物素基AMP简单地扩散离开BirA *部分,并与邻近的任何可用的胺基团反应 - 包括存在于附近多肽中的赖氨酸残基上的那些胺基团。经过严格的细胞裂解后,链霉抗生物素蛋白 - 琼脂糖可用于有效分离生物素复合物。经大量洗涤后,肽从固相支持物洗脱并用MS鉴定。Roux等人 首先通过鉴定293细胞中人类lamin A蛋白的相互作用的配偶体,最先证明了这种方法的可行性。其他研究最近已经使用BioID来鉴定Try-panosome蛋白的相互作用,涉及人类河马通路信号的多肽,紧密连接,粘着连接和人类中心相关蛋白。
c-MYC(MYC)致癌基因在超过50%的人类癌症中被放松管制。 然而,这种蛋白质在正常细胞生物学和肿瘤进展中的作用仍然不太清楚,部分原因是MYC相互作用的表达相对较差。 MYC蛋白质异常不稳定(半衰期仅为30分钟),大部分MYC与染色质紧密相关,使用标准AP-MS鉴定综合MYC相互作用的方法在技术上具有挑战性。 因此,开发一种新的策略,以了解含MYC的蛋白质复合物,将成为癌症研究的重要进展。
已经使用二维培养系统来描述细胞生物学的许多重要方面,但是现在已经清楚的是三维细胞组织,其它细胞类型的细胞间通讯,细胞外基质组成以及细胞微环境的其它方面显著影响细胞的行为和功能。 因此,在体内三维体系如异种移植物中评估质子泵抑制剂的方便方法也将是非常有用的。
BioID已经被证明是用于描述质子泵抑制剂的有希望的方法,但是迄今为止,它仅被应用于在培养细胞中相对少量多肽的表达。 在这里,我们所研究的BioID还可用于描述肿瘤异种移植物中染色质相关蛋白的蛋白质 - 蛋白质相互作用,并提供第一个综合的,高信度的基于生物体的体内MYC相互作用体。
- 材料和方法
2.1 克隆
使用含有AscI和NotI限制酶位点的引物PCR扩增编码MYC蛋白质(P01106)的人MYC cDNA(NCBI基因ID 4609)(AAAAAAGGCGCGCCTATGCCCCTCAACGTTAGC 和AAAAAAGCGGCCGCTTACGCA CAAGAGTTCCG), 并克隆到我们之前所说的pcDNA5 Flag-BirA *载体。
2.2 体内BioID
将200万个Flag-BirA * 293T-REx细胞或Flag-BirA * -MYC 293 T-REx细胞按照 加拿大动物保护委员会的准则注射到小鼠的左侧和右侧(6-8周龄的NOD-SCID雄性小鼠)。 在饮用水中以四环素盐酸盐(Sigma)诱导MYC融合蛋白表达(2g / l,从第1天开始)直到实验结束。 用卡尺测量肿瘤大小,等达到大约800mm 3(细胞注射后大约8周),在小鼠腹膜内注射30mu;g生物素(0.15mg / ml在PBS中),每天一次,持续两天。 第三天,用异氟烷麻醉小鼠,处死,移除异种移植物并迅速冷冻。将冷冻的异种移植物用研钵和研杵粉碎,将粉末重新悬浮于冷的改良的RIPA缓冲液(1%NP-40,0.5%脱氧胆酸钠,50mM Tris-HCl pH7.5,150mM NaCl,1mM EDTA,1 mM EGTA,0.1%SDS,1:500蛋白酶抑制剂混合物(Sigma)),以1:5的比例,溶解在均质组织匀浆器(Kontes)中,并与250U苯甲酸酶核酸酶(EMD)一起在 4°C孵育1小时。 将溶液超声处理3times;30秒(Fisher Scientific D100声速除菌仪,输出功率7W),并在4℃以27,000times;离心30分钟。 将得到的上清液与30mu;l(RIPA平衡)链霉抗生物素蛋白 - 琼脂糖凝胶珠(GE)在4℃末端旋转2小时孵育。 在胰蛋白酶消化之前,将珠子用7times;1ml 50mM硫酸铵铵(pH8.0)洗涤。
2.3 在培养细胞中的BioID
用1mu;g/ ml四环素和50mu;M生物素处理Flag-BirA *或Flag-BirA * -MYC 293T-REx细胞(约60%融合)分别诱导转基因表达和生物素标记24小时。 将细胞刮到PBS中,合并,在25ml PBS中洗涤两次,并在4℃下以1000times;g离心5分钟后收集。 将细胞沉淀在5ml冷的改良的RIPA缓冲液中裂解。 加入250U苯甲酸酶(EMD),分离如上所述的生物素化蛋白质。
2.4 质谱
将溶解在70mu;l50mM碳酸氢铵(pH8.3)中的1微克MS级TPCK胰蛋白酶(Promega,Madison,WI)加入到链霉抗生物素蛋白 - 琼脂糖珠中,并在37℃下孵育过夜。 收集洗脱液,珠子在100mu;l50mM碳酸氢铵中洗涤两次。 将合并的洗脱液冻干,然后重悬于0.1%甲酸中。 使用InnovaQuartz(Phoenix,AZ)的熔融石英毛细管内部制造的LC分析柱(内径75mu;m)和预柱(150mu;m内径)并填充100Aring;C18涂层二氧化硅颗粒(Magic,Michrom Bioresources,Auburn,CA)。对肽进行nanoLC-ESI-MS / MS,使用Proxeon EASY-nLC泵根据混合线性四极离子阱 (Velos LTQ)的轨道质谱仪 (Thermo Fisher Scientific, Waltham, MA)
反相(10-30%乙腈,0.1%甲酸)缓冲液梯度以250nl / min运行95分钟。在Orbitrap中使用60,000的分辨率进行母离子扫描。同时,选择最多二十个最强峰使用标准CID碎裂,用于MS / MS(用于激活的最小离子计数为1000)。在LTQ中检测片段离子。激活动态排除,在30秒的分析过程中使得MS / MS中相同的m / z(在10ppm窗口内的排除列表大小500)在15秒内检测到并排除。
对于蛋白质鉴定,使用Proteowizard 将Thermo.RAW文件转换为.mzXML格式,然后使用Mascot和Comet搜索引擎搜索人类RefSeq版本45(附加基于Refseq v45的反向诱饵数据库)。搜索参数指定了15 ppm的亲本MS耐受性和0.4 Da的MS / MS片段离子耐受性,最多允许有两个胰蛋白酶的缺失裂解。允许甲硫氨酸的氧化作为可变的修饰。使用至少两个技术重复分析每个异种移植物。使用iProphet作为跨蛋白质组管道的一部分,对肽和蛋白质鉴定进行统计验证。对于每个搜索,使用1%错误率的iProphet概率作为截断值来生成SAINT兼容的输入文件。 SAINT参数如下:重复5000次,低模式关闭,minFold 1和正常化。所有原始文件均可在UCSD Massive网站下载。项目名称:Dingar_in_vivo-BioID_ P103_VS6,ftp://MSV000078518.massive.ucsd.edu
2.5 免疫沉淀和免疫印迹分析
细胞裂解物与2mu;gIgG(sc-2027,Santa Cruz Biotechnology)或MAX抗体(sc-765,Santa Cruz Biotech-nology)4℃孵育过夜。 第二天,加入15mu;蛋白质G-sepharose珠(GE Healthcare),裂解物在4℃下进行末端转动4小时。 最后,将珠粒沉淀(425times;g,2分钟),用裂解缓冲液洗涤3次,重悬于2times;SDS样品缓冲液中,加热至95℃5分钟。 经短暂离心后,将样品进行10%SDS-PAGE,并转移到硝酸纤维素膜上。 蛋白质印迹见参考文献[19]。
2.6 免疫荧光显微镜
稳定的T-REx细胞表达标记蛋白在聚-L-赖氨酸(Sigma)涂覆的盖玻片上生长,用4%甲醛固定15分钟,并在含有0.25%Triton X-100的PBS中洗涤。 将细胞在PBS中的5%牛血清白蛋白(BSA)中封闭30分钟,然后在PBS 1:1000抗FLAG M2(Sigma)一抗中孵育1小时。 在1:1000和1:5000分别使用次级抗小鼠Alexa 488和Streptavidin-Alexa 594(Life Technologies),并在室温下孵育1小时。除去溶液后,将细胞与1mu;g/ ml 4,6-二亚氨基-2-苯基吲哚(DAPI)在PBS中一起孵育5分钟。 将盖片用PBS洗涤三次,每次5分钟,并用ProLong Gold Antifade(Thermo Fischer Scientific)装载。 在Olympus FV1000共聚焦显微镜(缩放因子介于3和5之间; Olympus America,Melville,NY)上,使用PlanApo 60times;油镜片NA 1.40对细胞成像。 使用Volocity Viewer v.6处理图像,并使用Adobe Illustrator CS5(Adobe Systems Inc.)进行组装。
2.7 网络分析
交互数据从STRING数据库v.9.1 [20]下载,并使用Cytoscape软件v.3.0.1 [21]进行修改。 以前识别的MYC交互器的分配基于BioGRID3.2数据库中的注释[22]。 为了简单起见,未显示不同蛋白质复合物和未连接的蛋白质节点之间的相互作用。
2.8 GSC分析
所有ChIP-seq转录因子结合位点被ENCODE[23]映射到K562细胞中,使用BEDTools [24]合并。 分析MYC结合位点与BioID在此识别的高置信MYC相互作用蛋白质的一致性结合,使用基因组结构测定(GSC)测试[25]。 在Z评分gt; 2.9913(Bonferroni校正)下确定alpha;= 0.05的统计学显着性。 以前确定为与MYC的共事件结合非统计学显着的三个转录因子被包括在分析中作为阴性对照。
2.9 邻近连接试验
将总共1
剩余内容已隐藏,支付完成后下载完整资料
资料编号:[141480],资料为PDF文档或Word文档,PDF文档可免费转换为Word




