从胚胎干细胞中通过谱系选择分离纯化神经前体的研究外文翻译资料
2023-01-06 11:22:57
从胚胎干细胞中通过谱系选择分离纯化神经前体的研究
原文作者:Meng Li, Larysa Pevny,Robin Lovell-Badge and Austin Smith
摘要:小鼠胚胎干细胞(ES)的非转化细胞系直接从小鼠胚胎多能干细胞的创始组织的外胚层派生 【1-3】。胚胎干细胞聚集引发一种不同的细胞类型的产生,包括神经元细胞【4-7】。这种生产能力为多向分化通过基因操纵和基因扩张来保留【8】。因此在原则上,胚胎干细胞为体外发育途径的分子和遗传分析提供了一个有吸引力的系统。它们也是移植研究的一个潜在的细胞来源。然而在这混乱的和异质性的文化发展中这些前景已经受挫。因此,我们为谱系限制前体分化的遗传选择已经开发了一种策略。因此我们可以报告应用这种谱系选择能够有效地净化神经上皮祖细胞随后有效地分化成在其他类型细胞中没有的神经网络。
关键词:胚胎干细胞
为了诱导神经分化,胚胎干细胞聚集在悬浮液中形成拟胚体暴露于视黄酸,然后使其重新附加到底层【4,6】。神经元样细胞可以在生长物中检测,伴随着各种其他类型的细胞。我们介绍增强神经元细胞最终表达的两个版本的科学实验报告。首先,对胚状体电镀前解离,这导致了均匀分散并终止拟胚体中的感应和选择性的影响。其次,将细胞接种于培养基DMEM/F12加涂有多聚赖氨酸和N2补充对层粘连蛋白基质,来支持神经细胞的附着和生长。
这些程序对在培养基中的神经细胞有一个比例的相加效应。当结合时,存活细胞中的高达50%的延伸神经炎进程,并成为免疫反应的神经元标记物的神经丝轻链和重链,微管相关蛋白,MAP2和tau,或beta;微管蛋白III。所占比例较小的细胞,达到20%,表示星形胶质细胞标志物神经胶质原纤维酸性蛋白(GFAP)。用三个独立的ES细胞系来获得比较的结果。然而,非神经细胞类型留在这些培养物中,特别是扁平上皮样细胞。如果该基础培养基补充有血清或碱性成纤维细胞生长因子(bFGF或FGF-2),这些非神经细胞迅速扩大,并逐渐成为主要的细胞类型(数据未显示)。
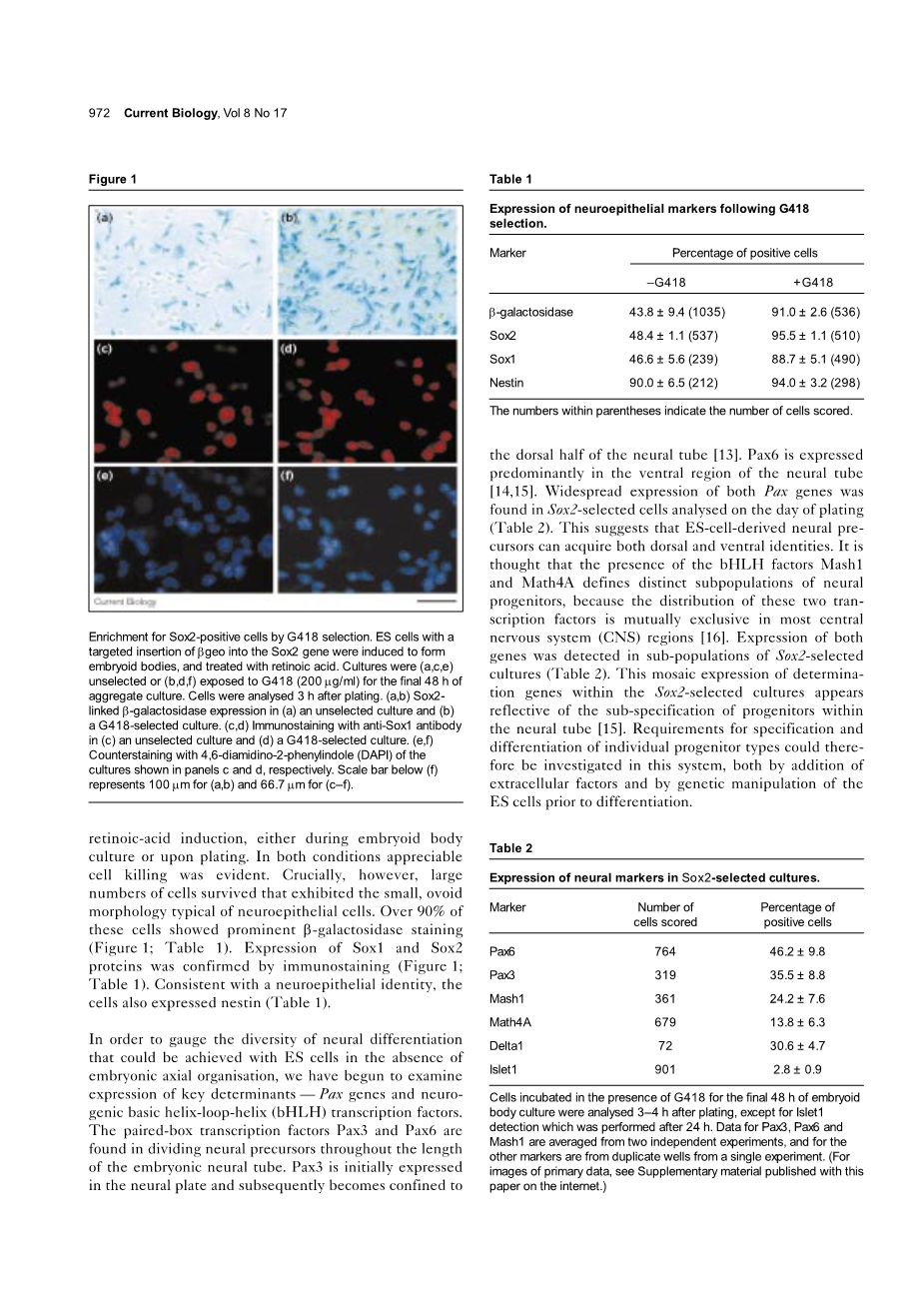
在电镀时,既不能用神经细胞检测也不能用星形胶质细胞标志物检测。因此,对这个阶段的培养物进行检查其神经前体标记物的表达。几乎所有的细胞表达的中间丝蛋白、神经巢蛋白,在神经上皮表达,而且在体节中胚层也有表达【9,10】。该SRY相关的转录因子SOX1和Sox2是更具体的标记。SOX1局限于神经板的神经上皮和早期小鼠胚胎中的神经前体细胞分化【11】,而SOX2被发现是重叠的图案,并包括底板和早期神经嵴细胞【12】。新鲜接种的细胞与抗SOX1和Sox2的抗体的免疫染色,发现该细胞的40-50%的每个标记是阳性的(图1;表1)。这是接近分化神经细胞最后的部分,与细胞中表达Sox1和Sox2的观念相一致对应神经受限祖细胞。
试图分离神经祖细胞池,我们使用的胚胎干细胞中,双选择标记/报道基因beta;geo通过同源重组已经融入了Sox2基因 (A. Avilion, S. Nicolis, L.P., L. Perez, N. Vivian, R.L.-B., unpublished)。当上述诱导分化,约50%的细胞染色beta;-半乳糖苷酶的活性(图1;表1),随着细胞表达Sox2蛋白比例一致。因此,我们推断,应用G418分化培养基应消除SOX2阴性的非神经细胞。G418(200微克/毫升)是添加维甲酸诱导后,在拟胚体培养或电镀。在这两种情况下明显的细胞死亡是显而易见的。然而,最重要的是,大量的细胞存活,表现出小的、卵圆形形态典型的神经上皮细胞。超过90%的细胞具有显著的beta;-半乳糖苷酶染色(图1;表1)。表达基因和Sox2蛋白经免疫组化染色(图1;表1)。与神经上皮的身份一致,细胞也表达了巢蛋白(表1)。为了衡量神经分化的多样性,胚胎干细胞在胚胎的轴向组织的情况下可以实现,我们已经开始研究表达的关键决定因素--Pax基因和神经核碱性螺旋-环-螺旋(bHLH)转录因子。paired-box转录因子Pax3和Pax6在分裂神经前体细胞胚胎神经管被发现。Pax3最初是表达在神经板,继而成为局限于神经管的背侧半【13】。Pax6基因主要在神经管的腹侧区表达【14,15】。两种Pax基因广泛表达在Sox2选定的细胞对电镀时间的分析时被发现(表2)。这表明,胚胎干细胞来源的神经前体可以获得背和腹的身份。普遍认为bHLH因子Mash1和Math4A定义不同的神经祖细胞亚群的存在,因为在大多数中枢神经系统的地区这2个转录因子的分布是相互排斥的【16】。在Sox2的选择培养物的亚群中检测到这两个基因的表达(表2)。在Sox2的选择培养物中确定基因的镶嵌表达出现反射在神经管sub-specification的祖细胞【15】。因此,在这个系统中进行调查个体祖细胞类型的规范和分化的要求,都应将细胞外因子的加入,并在胚胎干细胞分化前通过遗传操作。
早期神经细胞分化的标志物被检查。Notch配体Delta1是致力于细胞前细胞分化表达。【17】。Delta1的转录在电镀的当天细胞中被检测出约30%,这表明细胞中有少数已经致力于终末分化。在Sox2选择培养基中通过原位杂交和免疫组化检查,LIM同源结构域蛋白Islet1表达的是运动神经元和腹部中间神经元分化的早期标志物。少量的阳性细胞(2 - 3%)是可在电镀后24 - 48小时之内重复检测的(表2)。这表明特定的神经元亚型分化可以在这些培养基中启动。
Sox和Pax基因共表达与体内增殖神经外胚层相关。为了确定Sox2选择种群是否有增殖能力,将bFGF(碱性成纤维细胞生长因子)【19,20】添加到电镀过的培养基中。这是导致细胞分裂的一个主要刺激。图2显示了典型的添加了bFGF的x-gal-stained培养基培养24小时和96小时后。扩大细胞主要保留了未分化形态,表现出较强的X-gal染色来指示Sox2的表达。这样的培养基可以被放大和连续传代至少三周,这显著长于在小鼠胚胎神经发生的增殖阶段。
在没有有丝分裂原的情况下,在48小时内Sox2选择前体细胞开始延长神经突起,96小时形成神经元样细胞网络(图3b)。泛神经元标记物神经丝轻链(数据未显示),微管相关蛋白,MAP2和tau,或beta;微管蛋白III从48小时开始检测,与Sox2表达的反向调节相一致。96小时,超过90%的细胞表达神经元标记物,包括神经丝重链和突触素I。非神经元形态的细胞不明显,除了少数的GFAP阳性星形胶质细胞。如果血清或FGF被添加到培养基中那么星形胶质细胞数目就会增加。gamma;-氨基丁酸(GABA)和谷氨酸神经递质(见补充材料)的产生证明了神经细胞的成熟。在补充有B27和马血清的神经递质上,神经突树突发芽的进一步延伸(图3b)。
这种能力来产生纯粹的神经元群体,结合相对容易的遗传修饰的胚胎干细胞。提供一个新的操作和表征的神经发育和细胞生物学的路线。发现胚状体的主要细胞成分可以消融无明显扰动的存活细胞的发展,也表明这种策略可以适用于分离干细胞或前体细胞的其他谱系。一个重要的属性不同于免疫纯化技术,这种方法并不局限于细胞表面的抗原,可以适用于任何基因表达差异的其他产品性质。最明显的潜力是利用越来越多已发现的基因,编码转录因子与谱系限制的表达。选定的种群可以很容易地通过引入多个基因独立的标记。
靶向祖细胞相对于分化细胞【21】的优势是在体外【5】和体内的后续扩增和定向分化的潜力。胚胎干细胞衍生物可定植宿主组织,移植到成年受体后分化。然而,整个胚状体培养基的移植也会引起畸胎瘤和其他良性或恶性肿瘤【22,23】。此外,异源细胞可能会干扰从宿主组织到移植细胞的营养信号和引导线索。以前的世代纯化应该消除这些问题,并且使多能胚胎干细胞可以有效地应用在细胞移植中。
参考文献
1. Brook FA, Gardner RL: The origin and efficient derivation of embryonic stem cells in the mouse.Proc Natl Acad Sci USA 1997, 94:5709-5712.
2. Evans MJ, Kaufman M: Establishment in culture of pluripotential cells from mouse embryos.Nature 1981, 292:154-156.
3. Martin GR: Isolation of a pluripotent cell line from early mouse embryos cultured in medium conditioned by teratocarcinoma stem cells. Proc Natl Acad Sci USA 1981, 78:7634-7638.
4. Bain G, Kitchens D, Yao M, Huettner JE, Gottlieb DI: Embryonic stem cells express neuronal properties in vitro.Dev Biol 1995, 168:342-357.
5. Okabe S, Forsberg-Nilsson K, Spiro AC, Segal M, McKay RDG:Development of neuronal precursor cells and functional postmitotic neurons from embryonic stem cells in vitro. Mech Dev 1996, 59:89-102.
6. Fraichard A, Chassande O, Bilbaut G, Dehay C, Savatier P, Samarut J: In vitro differentiation of embryonic stem cells into glial cells and functional neurons.J Cell Sci 1995, 108:3181-3188.
7. Strubing C, Ahnert-Hilger G, Shan J, Wiedenmann B, Hescheler J, Wobus AM: Differentiation of pluripotent embryonic stem cells into the neuronal lineage in vitro gives rise to mature inhibitory and excitatory neurons.Mech Dev 1995, 53:275-287.
8. Robertson EJ: Teratocarcinoma and Embryo-derived Stem Cells: a Practical Approach. Oxford: IRL Press; 1987.
9. Lendahl U, Zimmerman LB, McKay RDG: CNS stem cells express a new class of intermediate filament protein.Cell 1990, 60:585-595.
10. Sejersen T, Lendahl U: Transient expression of nestin during skeletal muscle development.J Cell Sci 1993, 106:1291-1300.
11. Pevny LH, Sockanathan S, Placzek M, Lovell-Badge R: A role for Sox1 in neural determination.Development 1998, 125:1967-1978.
12. Collignon J: Study of a New Family of Genes Related to the Mammalian Testis Determining Gene. PhD Thesis, Council for National Academy Awards, London; 1992.
13. Liem KF, Tremmi G, Roelink H, Jessell TM: Dorsal differentiation of neural plate cells by BMP-mediated signals from epidermal ectoderm. Cell 1995, 82:969-979.
14. Walther C, Gruss P: Pax-6, a murine paired box gene, is expressed in the developing CNS. Development 1991, 113:1435-1449.
15. Tanabe Y, Jessell TM: Diversity and pattern in the developing spinal cord. Science 1996, 274:1115-1123.
16. Gradwohl G, Fode C, Guillemot F: Restricted expression of a novel murine atonal-related bHLH protein in undifferentiated neural precursors.Dev Biol 1996, 180:227-241.
17. Henrique D, Adam J, Myat A, Chitnis A, Lewis J, Ish-Horowicz D: Expression of a
剩余内容已隐藏,支付完成后下载完整资料

英语原文共 6 页,剩余内容已隐藏,支付完成后下载完整资料
资料编号:[286426],资料为PDF文档或Word文档,PDF文档可免费转换为Word




