基于内质网应激阻断奥氮平所致药源性肥胖的研究毕业论文
2020-03-04 08:54:42
摘 要
第二代抗精神病药物(Second generation antipsychotic drugs,SGAs)奥氮平,是临床上治疗精神分裂症的一线药物之一。然而,临床数据显示奥氮平有严重的体重增加/肥胖副作用,这对患者的身心健康及用药依从性会产生极大的负面影响。目前,人们对由奥氮平所导致的药源性肥胖的神经药理学机制的认识还很不完善。近年来,越来越多的证据表明下丘脑内质网应激PERK-GRP78信号通路对肥胖的形成具有关键作用,故探索奥氮平对该信号通路的调控规律及相关药物干预,对明确奥氮平所致肥胖的关键机制及解决药源性肥胖问题具有重要意义。本研究运用蛋白质印迹法分别在体外(人神经母细胞瘤细胞株SH-SY5Y)和体内(SD大鼠下丘脑)中研究了奥氮平对内质网应激PERK-GRP78通路的调控规律及其与肥胖的关系;其次,探索内质网应激抑制剂4 -苯基丁酸(4-PBA)对奥氮平所致摄食增高和体重增加的抑制效果。研究发现,奥氮平在体外显著激活内质网应激PERK- GRP78信号通路关键分子,包括phosphor-PERK (p-PERK)、p-eIF2α、ATF4以及GRP78。进一步动物实验研究发现,奥氮平给药8天导致SD大鼠摄食、体重、外周脂肪(包括肾周脂肪、卵巢周脂肪及肠系膜脂肪)显著增加。奥氮平给药显著性激活了下丘脑内质网应激PERK-GRP78信号通路。外周给药4-PBA呈剂量依赖性地降低了奥氮平所致SD大鼠摄食和体重增加。综上所诉,下丘脑内质网应激PERK-GRP78通路的激活在奥氮平所致肥胖的形成中有重要作用,内质网应激抑制剂可能是治疗SGAs所致药源性肥胖极具潜力的药物之一。
关键词:奥氮平;药源性肥胖;内质网应激;下丘脑;PERK-GRP78通路
Abstract
Second generation antipsychotic drugs (SGAs), especially olanzapine, are first-line drugs for clinical treatment of schizophrenia. However, clinical data show that olanzapine causes weight gain and even obesity in patients, which seriously affects the patient's physical and mental health and medication compliance. At present, the neuropharmacological mechanism of obesity caused by olanzapine is not yet clear. Numerous evidence shows that the hypothalamic endoplasmic reticulum (ER) stress PERK-GRP78 signaling pathway plays a key role in obesity development. Therefore, it is of great significance to explore the regulation of olanzapine on the signaling pathway and the intervention of related drugs, to clarify the key mechanism of olanzapine-induced obesity. This study firstly investigated the regulative effect of olanzapine on the ER PERK-GRP78 signaling pathway in vitro (SH-SY5Y human neuroblastoma cell line) and in vivo (SD rat hypothalamus) using western blotting technology. Secondly, we explored the inhibitory effect of a specific endoplasmic reticulum stress inhibitor (4-phenyl-butyric acid, 4-PBA) on olanzapine-induced weight gain. The results showed that olanzapine significantly activated the key molecules of the ER PERK-GRP78 signaling pathway in vitro, including pPERK, pelF2α, ATF4 and GRP78. In vivo, oral olanzapine treatment for 8 days resulted in a significant increase in cumulative food intake, weight gain and white adipose tissue (including perirenal, periovary, and mesenteric fat) of SD rats. Moreover, olanzapine administration significantly activated the hypothalamic PERK-GRP78 signaling pathway. Oral co-treatment of 4-PBA dose-dependently reduced olanzapine-induced increased food intake and weight gain. In summary, the activation of PERK-GRP78 pathway in the hypothalamus may play an important role in the development of olanzapine-induced obesity. The ER stress inhibitor may be a potential drug for the treatment of SGA-induced obesity.
Key Words: Olanzapine; obesity; endoplasmic reticulum stress; hypothalamus; PERK-GRP78 pathway.
目 录
第一章 绪论 1
1.1 抗精神病药物(antipsychotic drugs,APs) 1
1.2 SGAs所致药源性肥胖 1
1.3 下丘脑内质网应激与肥胖的关系 3
1.4 内质网应激与肥胖 3
1.4.1内质网应激PERK-GRP78通路与肥胖 3
1.4.2 内质网应激与SGAs所致肥胖 4
1.5 本文研究目的及意义 4
第二章 体外检测奥氮平对神经细胞内PERK-GRP78信号通路的调控规律 6
2.1 实验材料 6
2.1.1 细胞来源 6
2.1.2 主要试剂和材料 6
2.2.实验方法 6
2.2.1 SH-SY5Y细胞培养 6
2.2.2 正式试验 7
2.3采用免疫印迹法检测 PERK-GRP78信号通路相关蛋白的表达水平 7
2.3.1 实验器材 7
2.3.2 主要实验试剂 8
2.3.3 实验步骤 9
2.4 统计学分析 10
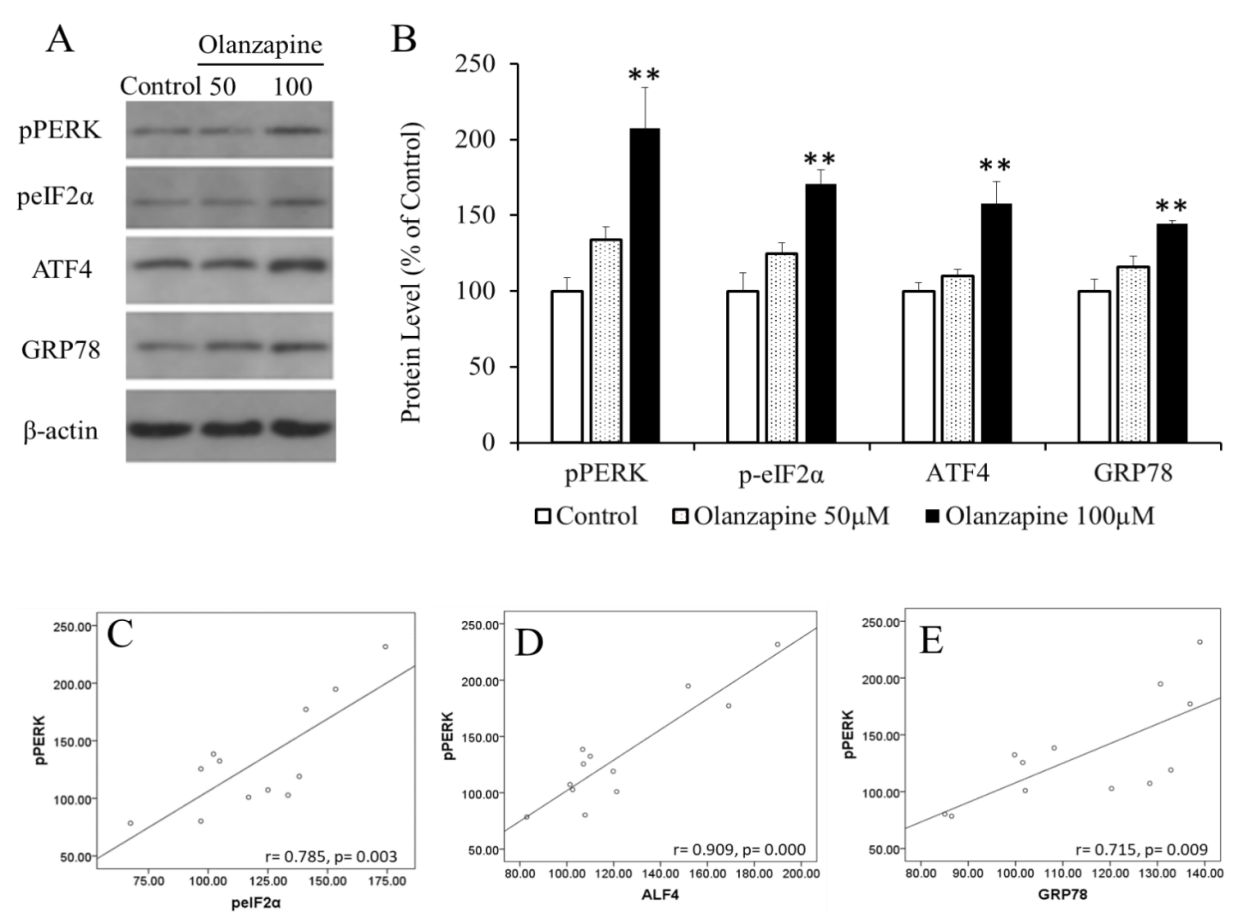
2.5 结果 11
第三章 大鼠口服奥氮平对下丘脑内质网应激PERK-GRP78信号通路的影响 13
3.1 实验动物和药品 13
3.2 方法 13
3.2.1 动物分组与饮食 13
3.2.2 观察指标及动物组织采集 13
3.3免疫印迹法检测大鼠下丘脑内质网应激PERK-GRP78信号通路关键分子的蛋白表达 14
3.4 统计学分析 14
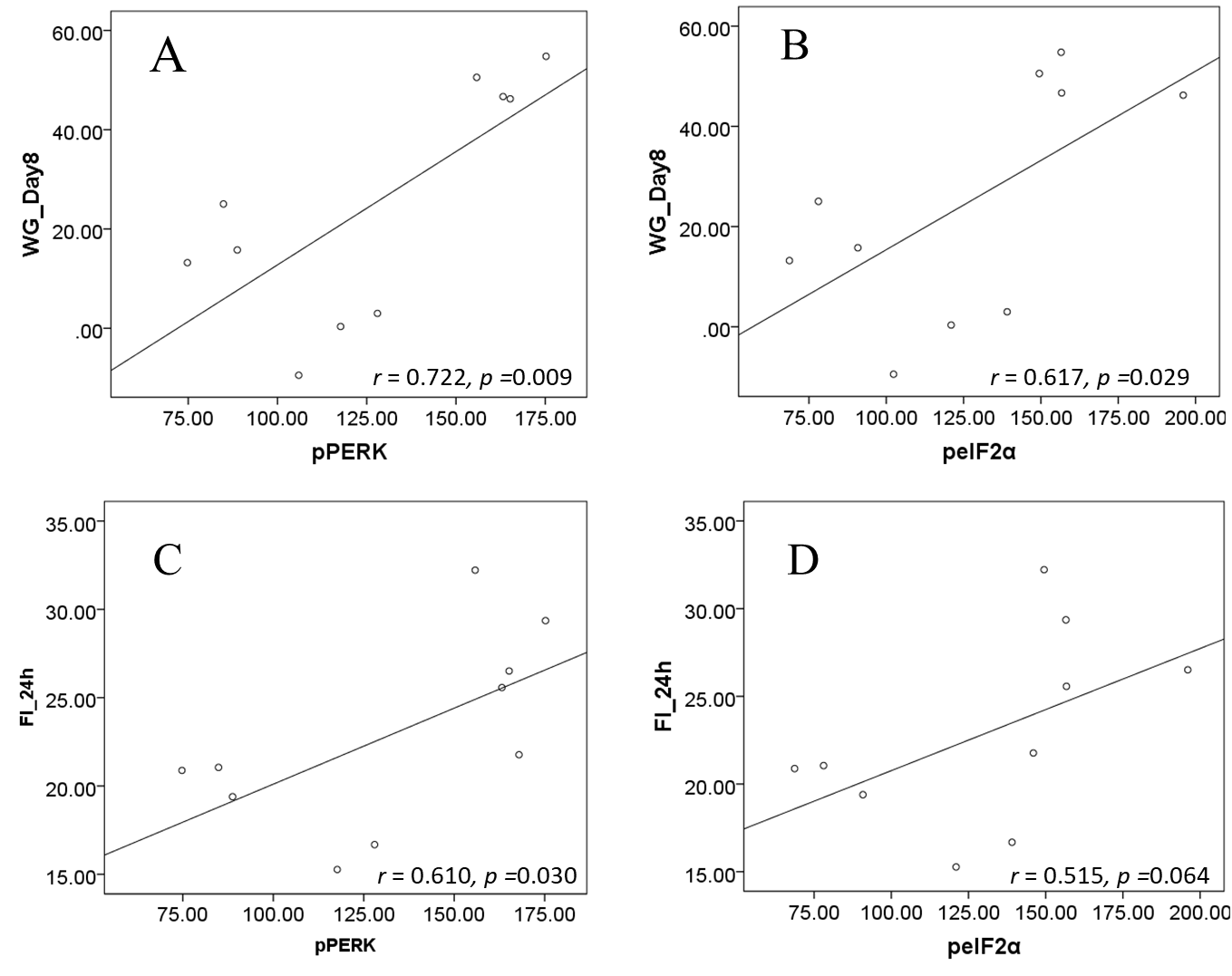
3.5 结果 14
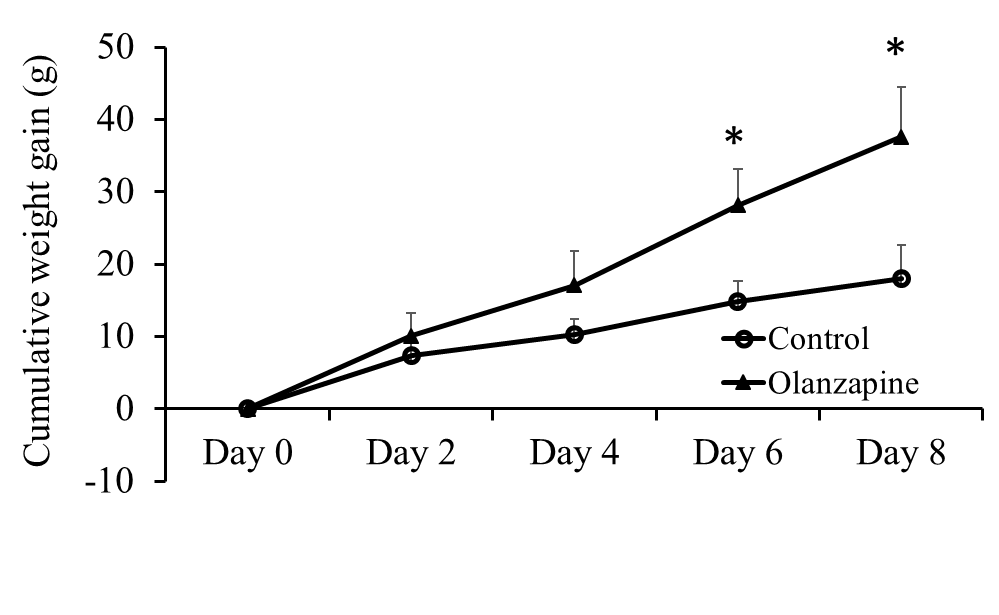
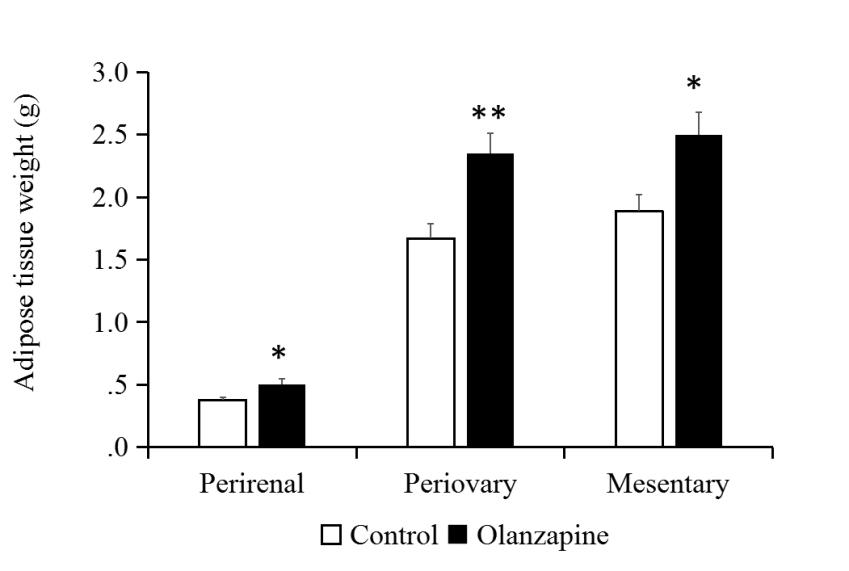
3.5.1 大鼠状况观察 14
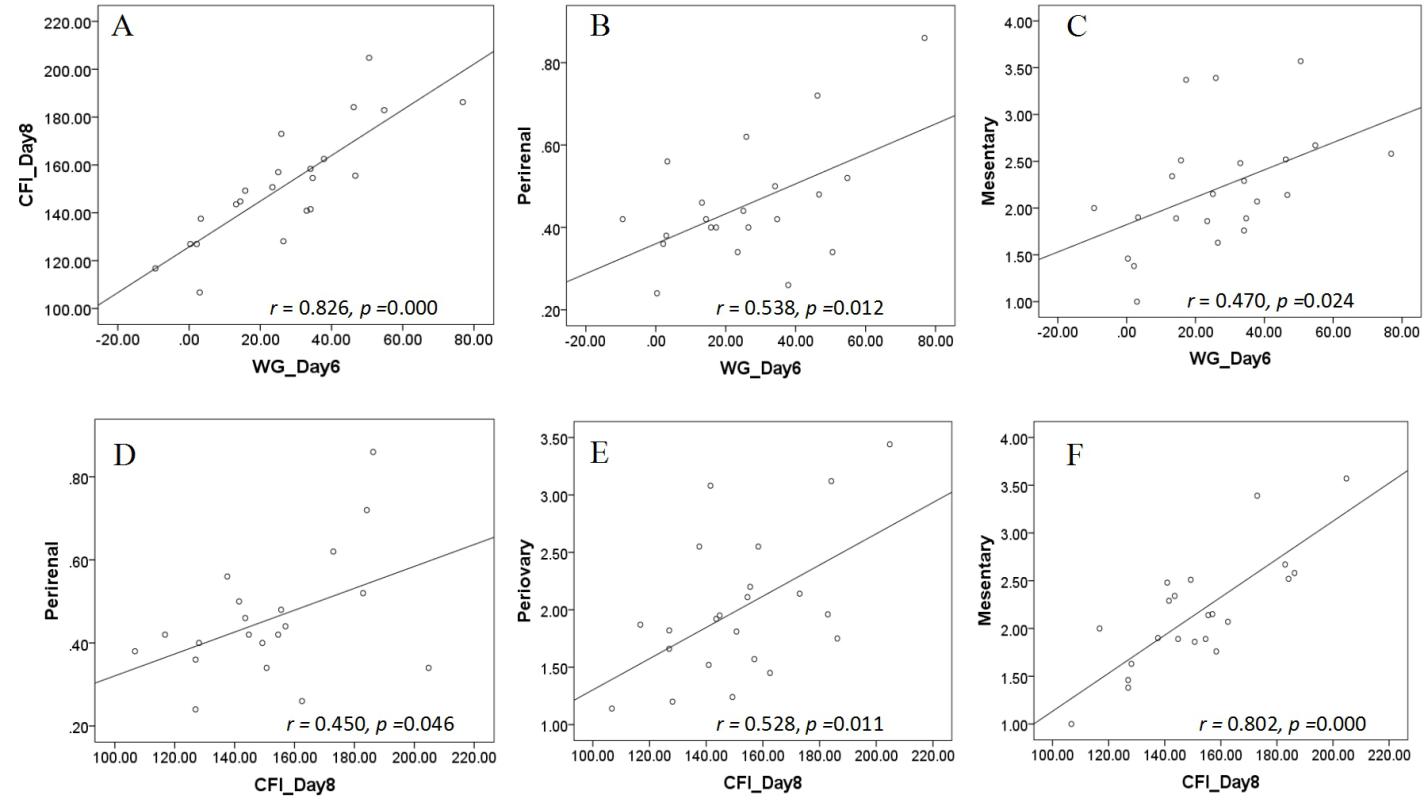
3.5.2 口服奥氮平给药对大鼠摄食、体重和脂肪的影响 14
3.5.3 口服奥氮平给药对内质网应激PERK-GRP78信号通路关键分子的影响 17
第四章 内质网应激抑制剂对奥氮平所致肥胖的减肥作用 19
4.1 实验动物和药品 19
4.2 动物实验 19
4.3 统计学分析 19
4.4 结果 19
4.4.1 大鼠状况观察 19
4.4.2 口服内质网应激抑制剂4-PBA对大鼠摄食、体重和脂肪的影响 20
第五章 讨论 22
参考文献 24
致 谢 27
绪论
1.1 抗精神病药物(antipsychotic drugs,APs)
精神分裂症是指大脑高级神经活动严重障碍的重症精神类疾病,主要表现思维障碍(如幻觉、妄想)和行为障碍(活动减少、攻击行为)的等阳性症状,同时伴有思维障碍(淡漠、情感麻木和抑郁)等阴性症状和认知功能障碍(学习、工作记忆障碍)[1]。在过去,治疗精神分裂症主要靠电休克疗法或胰岛素疗法,但这种方法对病患伤害极大。随着氯丙嗪的问世,精神分裂症的治疗进入药物治疗时代。这类药物统称为抗精神病药,其主要作用机制为与脑内多巴胺能神经元受体D2结合(拮抗作用或部分激动作用),来拮抗过高的多巴胺能神经元功能,消除患者幻觉、妄想等症状,从而使患者恢复理智[2]。目前,抗精神病药物分为三代。其中,第一代抗精神病药(First generation antipsychotics,FGAs),也可称之为典型抗精神病药,比如氯丙嗪,在临床治疗精神病性症状中有着颇为广泛的应用,但大量相关研究已发现,FGAs对精神病阳性症状效果显著,但其对精神分裂症的阴性症状无效甚至会加重病情,并且多数FGAs存在易于引起锥体外系反应和植物神经功能障碍的严重副作用,其临床应用受到了极大的限制;在上世纪90年代,氯氮平的问世标志着第二代抗精神病药(Second Generation antipsychotics,SGAs)的问世,SGAs包括了氯氮平和奥氮平等,此类药物不仅可以很好地治疗精神分裂症的各种症状,而且不会引起锥体外系反应,因而SGAs成为临床上治疗精神分裂症和其他精神障碍的主要方法[3]。然而SGAs尤其是奥氮平、氯氮平会引起许多代谢性疾病,例如脂质代谢紊乱、肥胖、糖尿病等,这些副作用显然不利于患者身心健康和疾病治疗。在2002年,随着日本大冢制药研发的阿立哌唑的上市,标志着第三代抗精神病药物投入临床使用。然而,阿立哌唑由于其疗效及其他不良反应原因无法取代SGAs在临床上的重要位置,SGAs尤其是奥氮平依然是临床使用的一线药物。
1.2 SGAs所致药源性肥胖
几乎所有SGAs均可引起不同程度的体重增加[4]。众多临床数据显示,氯氮平和奥氮平是SGAs中肥胖副作用最为显著的,其次是喹硫平和利培酮,阿立哌唑和齐拉西酮的肥胖副作用则比较轻微[5](图1.1)。进一步研究发现,尽管人们愈发认识到SGAs所致的肥胖副作用,但这种副作用的严重程度一直被低估了。儿童患者或未接受过抗精神病药物治疗的患者,相比于以前接触过抗精神病药物的患者,体重增加的风险更高[6]。患者因素(比如年龄、身高体重指数、性别等)、疾病相关因素(比如是否初治、症状减轻的程度等)和治疗变量(比如用药持续时间、剂量、药物类型等)都会影响抗精神病药物所致的体重
增加[7,8]。由SGAs所致的药源性肥胖给患者带来了严重的负面影响。肥胖易使患者产生自卑的消极情绪,这会使患者的服药依从性大大降低,导致停药、减药甚至病情反复的恶劣后果,除此之外,许多代谢紊乱综合征均可由SGAs诱导发生,比较严重的如糖尿病和高血压[9]。因此,由抗精神病药所致的肥胖是一个亟待解决的问题。
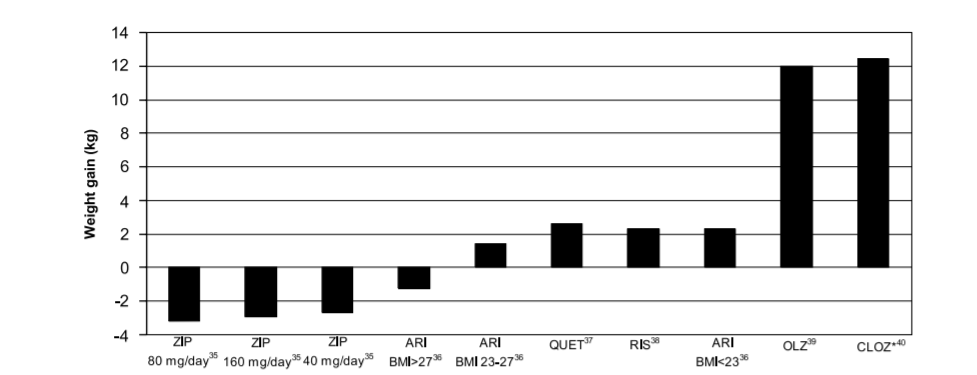
图1.1 临床抗精神病药物所致肥胖的综合分析[10]
目前SGAs所致肥胖的中枢药理学机制尚不完全明确。一般而言,抗精神病相关的体重增加和肥胖是由能量摄入(摄入的卡路里的类型、数量和频率)和能量消耗(活动或锻炼的类型、数量和频率)之间的不平衡引起的,而这种失衡是由药物诱导或加剧的[11]。而能量稳态涉及诸多调节途径和各方面因素,使得相关研究变得错综复杂。例如,前期研究发现奥氮平所致肥胖可能与下丘脑内组胺能神经系统H1受体阻断及其下游AMP依赖的蛋白激酶(AMP-activated protein kinase,AMPK)信号通路激活密切相关,中枢侧脑室注射H1受体激活剂,2-(3-三氟甲基苯基)组胺 (2- (3- three fluoromethyl phenyl) histamine, FMPH),可显著降低服用奥氮平的大鼠的过度摄食,然而遗憾的是H1受体激动剂FMPH不能透过血脑屏障,这极大的限制了H1受体阻断剂在临床治疗抗精神病药物所致肥胖的进一步研究[12]。然而,尚无相应药品进入临床用于治疗抗精神病药物所致肥胖。因此,进一步研究SGAs所致肥胖的中枢神经药理学机制及其相关药物研发,对治疗药源性肥胖有重要意义。
1.3 下丘脑内质网应激与肥胖的关系
下丘脑是机体的能量调节中枢,下丘脑不同核团之间构成了复杂的网络来调节摄食、散热和能量平衡[13]。众多研究已经将下丘脑确定为肥胖症的发病根源,认为肥胖起源于下丘脑功能调节的异常[14]。因此本研究将重点研究下丘脑功能紊乱与SGAs所致肥胖的关系,力求发现导致SGAs所致肥胖的关键原因。
内质网(endoplasmic reticulum,ER)是参与蛋白质合成折叠及转运以及脂质生成的重要场所[15]。蛋白质的折叠、成熟及其转运都与内质网的功能是否正常密切相关。遗传或环境损伤会引起细胞内钙稳态失衡和蛋白质错误折叠等不利反应,会导致内质网功能紊乱,诱发内质网应激(ER stress)[16]。当机体或细胞处于ERS状态时,由于在内质网表面合成的胆固醇损耗会造成胆固醇调节级联反应,由于蛋白质加工紊乱会造成内质网超负荷反应和未折叠蛋白反应(unfolded protein response,UPR)[17]。在正常情况下,不适当折叠的蛋白质通过用于蛋白酶体降解的ER递送至胞质溶胶。尽管如此,强烈和长时间的细胞扰动可能会改变ER稳态,导致潜在的有毒错误折叠蛋白质积累和内质网应激的加剧。为了保证在这些条件下足够的ER性能,这种细胞器激活了一整套系统发育上保守的、压力重新激活的信号传导通路,统称为UPR[18]。UPR因涉及许多细胞器之间的信号传递,故是目前研究的最为透彻的细胞器之间的信号传递通路[17]。适度的内质网应激对于细胞是有利的,能够恢复细胞的正常生理功能,保护细胞,但当内质网应激反应持续时间过长或过于强烈,则会诱导产生促凋亡因子,最终导致细胞凋亡,因而许多人类疾病都与内质网应激有着千丝万缕的联系,比如代谢性疾病和炎症性疾病等,但内质网应激参与诱导各种疾病发生的机制还不甚明确[16]。
1.4 内质网应激与肥胖
1.4.1内质网应激PERK-GRP78通路与肥胖
葡萄糖调节蛋白78 (glucoser egulatedp rotein,GRP78),是一种重要的分子伴侣蛋白,具有维持内质网的稳态并保护细胞的功能。当机体或细胞处于某些应激状态下时,GRP78的蛋白表达会显著增加,比如低Ca2 、低氧、低糖等。GRP78在正常的情况下会和内质网膜上的转膜蛋白:核细胞翻译起始因子2a (double-stranded RNA(PKR)-like ER kinase,PERK)、肌醇必需酶1(inositol—requiring kinase/endoribonuclease 1,IRE 1)和活化转录因子6 (activating transcription factor 6,ATF6) 结合在一起,此时的GRP78处于一种无活性的状态,但ERS会使它们发生解离,然后各自发挥作用以使蛋白质的折叠及转运朝着正常有序的方向进行,有助于恢复内质网稳态,待稳态恢复后,GRP78与PERK即重新结合[19](图1.2)。
肥胖与内质网应激关系密切,众多研究发现下丘脑内质网应激是调节体重的关键因素,肥胖小鼠下丘脑内质网应激信号分子pPERK,pelF2α和GRP78等表达显著升高[18,20,21]。激活下丘脑内质网应激造成动物摄食增高、肩胛间棕色脂肪(intrascapular brown adipose tissue,IBAT)分解和产热降低,从而起协同作用,共同导致动物肥胖[22,23]。而相反,抑制下丘脑内质网应激PERK-GRP78通路显著性降低了肥胖小鼠的摄食、增加了IBAT产热,从而抑制肥胖的发生[22,24,25]。因此,下丘脑内质网应激紊乱是导致动物机体肥胖的关键原因(图1.2)。
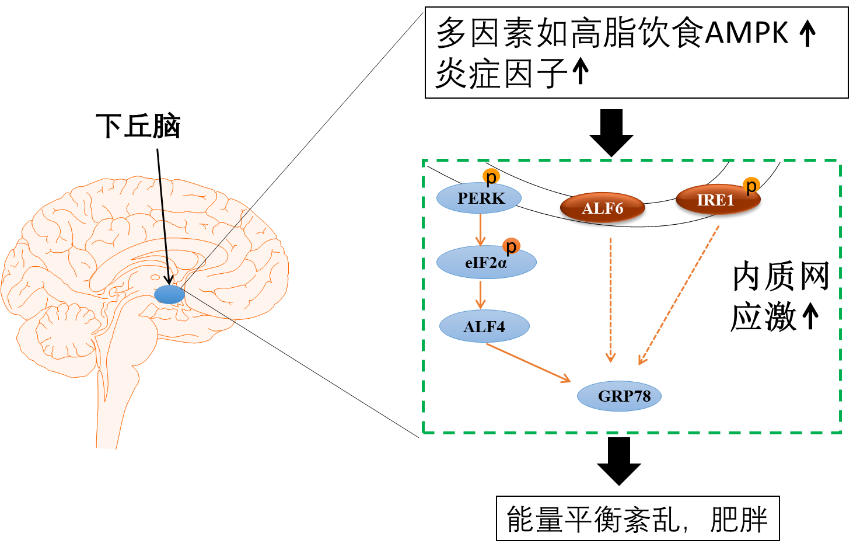
图1.2 下丘脑内质网应激与肥胖的关系
1.4.2 内质网应激与SGAs所致肥胖
SGAs所致肥胖与下丘脑内质网应激PERK-GRP78的关系目前尚不明确。在动物模型中研究发现,易致肥胖APs包括奥氮平、氯氮平和利培酮,会显著激活肝脏及β-胰腺细胞内质网应激信号分子PERK,该作用在SGAs所致脂代谢紊乱中起重要作用。同时,有相关研究发现SGAs(奥氮平和齐拉西酮)显著性激活下丘脑内质网应激直接调控因AMPK,并且AMPK的激活与奥氮平所致摄食和体重增加密切相关,此外,内质网应激也可调节神经肽(NPY)的表达,从而对动物的摄食及体重造成影响[12]。综上所诉,下丘脑内质网应激可能是SGAs(尤其是奥氮平)导致肥胖的关键因素,对该通路的干预将可能是治疗SGAs所致肥胖的重要措施。
1.5 本文研究目的及意义
据不完全统计,我国精神病患者过1亿,其中重症者1600万,精神分裂症700万,疾病负担(以伤残调整寿命年计算)居于全国首位[26]。SGAs是目前治疗精神类疾病最主要的手段。然而由于其广泛的肥胖副作用,严重影响了患者的健康并降低了患者的药物依从性,极大限制了APs的临床使用,显著提高了我国的医疗投入,给社会带来压力和负担。近年来,越来越多的证据表明下丘脑内质网应激PERK-GRP78信号通路在调节摄食和体重中占据重要作用,故探索SGAs对该信号通路调控规律及相关药物干预,对解决SGAs所致药源性肥胖问题及新药研发具有重要意义。
第二章 体外检测奥氮平对神经细胞内PERK-GRP78
信号通路的调控规律
体外研究不同浓度奥氮对内质网应激PERK-GRP78信号通路的调控规律,阐明奥氮平是否直接调控神经细胞内PERK-GRP78信号通路,为后续动物实验研究中枢下丘脑内内质网应激与奥氮平所致肥胖的关系提供基础。
2.1 实验材料
2.1.1 细胞来源
人神经母细胞瘤细胞株(SH-SY5Y)从武汉大学保藏中心购得。
2.1.2 主要试剂和材料
胎牛血清、DMEM/F12培养基购自Thermofisher,细胞培养皿和六孔板购自Thermofisher 公司,奥氮平购自Sigma-Aldrich公司(货号:01141)。各种型号的离心管购自Eppendorf 公司。
2.2.实验方法
2.2.1 SH-SY5Y细胞培养
(1)实验前准备
甲醛高锰酸钾熏蒸实验室, 2天后开放实验室用于杀灭细胞实验室内所有的微生物以及真菌孢子。在一切准备就绪后,清洁超净工作台面,准备好实验操作所需器材(移液器、培养皿和酒精棉球等),打开紫外灯进行紫外灭菌40分钟。
预先配置好DMEM培养基,于37℃孵育至所需温度备用。
- 细胞复苏
加热双蒸水至37℃,准备好操作所需器具并进行消毒。在预热好的双蒸水中融化冻存物,在离心管中混合好10 ml完全培养液和细胞悬液后,平衡离心取沉淀物,加入10 ml完全培养液,轻轻吹打以制备出均匀的细胞悬液,之后于37℃培养箱(含5% CO2)中培养。
- 细胞换液
SH-SY5Y细胞于24h内可完全贴壁生长,可于显微镜下观察其生长形态。应保证培养液每周更换2-3次,以保证细胞生长良好。操作中注意台面、器具的消毒。
- 细胞传代(消化法)
准备操作所需器具并消毒,用移液器弃去培养基,采用37℃PBS轻洗细胞2次,加入0.25%的胰蛋白酶液,消化30秒后终止消化。添加含胎牛血清培养基,后用吸管吹打均匀,获得细胞数量之后,移取相应量细胞悬液至新培养皿,加入新培养基,于30℃、5% CO2环境中培养[27]。
2.2.2 正式试验
将处于对数生长期的细胞接种于六孔板上,要求每孔应有105个细胞,共接种12孔。将12孔分为三组,分别为空白对照组、奥氮平高剂量组(100 µM)和奥氮平低剂量组(50 µM)。将奥氮平溶于DMSO配成10倍的母液,用时,吸取相应量奥氮平母液加入培养基中,使其终浓度为50 µM和100 µM,备用。待细胞生长24小时后,分别加入不同浓度奥氮平或对照(DMSO),采用无血清培养基培养24小时之后,弃去培养液,用37℃ PBS轻洗细胞2次。加入RIPA细胞裂解液(表2.2)使细胞裂解。20000g 4℃离心10分钟后取上清液,-80℃保存备用。
2.3采用免疫印迹法检测 PERK-GRP78信号通路相关蛋白的表达水平
2.3.1 实验器材
表2.1 WB实验中涉及的主要器材
名称 | 厂家 | 型号 |
微量移液器 | Eppendorf | |
电泳仪电源 | 北京六一仪器厂 | DYY-7C |
垂直电泳槽 | 北京六一仪器厂 | DYCZ-24DN |
电转仪 | 北京六一仪器厂 | DYCZ-40 |
水平摇床 | 江苏海门其林贝尔仪器制造有限公司 | TS-1 |
pH计 | 德国Metter-Toledo GmbH公司 | LP115 |
电子天平 | 北京赛多利斯仪器系统有限公司 | CPA |
磁力搅拌器 | 江苏省金坛市中大仪器厂 | T8-1 |
酶标仪 | Thermo | mμlISKANMK3 |
离心机 | 湖南湘仪实验室仪器开发有限公司 | HI650 |
2.3.2 主要实验试剂
表2.2 实验中涉及的主要试剂
名称 | 厂家 | 货号 | ||||||
磷酸酶抑制剂 | 碧云天 | S1873 | ||||||
PMSF | 碧云天 | ST506 | ||||||
RIPA裂解液 | 碧云天 | P0013B | ||||||
BCA蛋白浓度测定试剂盒 | 碧云天 | P0010 | ||||||
TEMED | Amresco | Amresc00761 | ||||||
Trise-Base | Amresco | Exp2017/12 | ||||||
HCl | 信阳市化学试剂厂 | GB622-89 | ||||||
二硫叔糖醇(DTT) | Biosharp | Amresco0281 | ||||||
SDS | 国药集团化学试剂有限公司 | 30166428 | ||||||
溴酚蓝 | Amresco | BO449-5G | ||||||
甘油 | 国药集团化学试剂有限公司 | 10010618 | ||||||
30%丙烯酰胺 | 丙烯酰胺 | Amresco | Exp2016109 | |||||
甲叉丙烯酰胺 | Amresco | Amresc00172 | ||||||
TG | Tris-base | 西格玛奥的(上海)贸易有限公司 | v900483 | |||||
甘氨酸 | Biosharp | Exp2017106 | ||||||
SDS | 国药集团化学试剂有限公司 | 10014118 | ||||||
电转液 | Tris-base | Biosharp | ||||||
甘氨酸 | Biosharp | |||||||
甲醇 | 国药集团化学试剂有限公司 | 10014118 | ||||||
PBS | NaCl | 国药集团化学试剂有限公司 | 10016318 | |||||
KCl | 国药集团化学试剂有限公司 | 10020318 | ||||||
Na2HPO4.12H2O | 国药集团化学试剂有限公司 | 10017618 | ||||||
KH2PO4 | 国药集团化学试剂有限公司 | 10019718 | ||||||
蛋白marker(14-120KD) | 北京全式金生物技术有限公司 | DM111 | ||||||
PVDF膜(0.45μm) | Millipore | IPVH00010 | ||||||
小鼠单抗β-actin | 42KD | 武汉博士德生物工程有限公司 | BM0627 | |||||
检测抗体 | ||||||||
兔单抗P-eIF2a(SER51)(38KD) | Cell signaling | 3597 | ||||||
兔单抗p-perk(170KD) 以上是毕业论文大纲或资料介绍,该课题完整毕业论文、开题报告、任务书、程序设计、图纸设计等资料请添加微信获取,微信号:bysjorg。 相关图片展示:
您需要先支付 80元 才能查看全部内容!立即支付
最新文档

| ||||||||