淀粉样蛋白寡聚体荧光探针的设计与合成毕业论文
2020-04-15 17:34:07
摘 要
阿尔兹海默症 (AD) 是一种神经退行性疾病,是痴呆症的形式之一,该病逐渐成为当今世界面临的最突出的难题之一。该病症主要表现为大脑功能退化、执行能力和记忆障碍、失语等。AD的病理学标志物有β-淀粉样蛋白 (Aβ) 沉积,乙酰胆碱转移酶水平降低,Tau蛋白过度磷酸化。研究表明,β-淀粉样蛋白 (Aβ) 聚集生在AD临床病症出现之前,其所引起的神经毒性被认为是AD的主要致病因素。其中 Aβ寡聚体的神经毒性最强。基于此,本论文设计、合成一个新型氟硼二吡咯类荧光探针,通过近红外区域荧光变化来识别Aβ寡聚体,为AD的早期诊断提出新的策略。
关键词:阿尔兹海默症 荧光探针 β-淀粉样蛋白寡聚体
Design and Synthesis of Amyloid Protein Oligomer Fluorescence Probe
Abstract
Alzheimer's disease (AD) ,the most common form of demetia, is a neurodegenerative disease and becoming one of the most devastating problems all around the world. The main symptoms of this disease are brain dysfunction, executive ability and memory disorders aphasia,and so on. Pathological biomarkers of AD include beta-amyloid (Aβ) deposition, decreased levels of acetylcholine transferase, and hyperphosphorylation of Tau protein. Aβ aggregation occurs before the onset of AD clinical symptoms. The neurotoxicity of Aβ aggregates has been recognized as the main pathogenic factor of AD and Aβ oligomers are the most neurotoxic aggregates. Based on this background, in this thesis, we designed and synthesized a new boron dipyrromethene-based fluorescent probe to trecognize Aβ oligomers through the response of near-infrared fluorescence,which would provide a new strategy for the early diagnosis of AD.
Key Words: Alzheimer's disease; Fluorescent probe;Aβ oligomers
目录
摘要 2
Abstract 3
第一章 绪论 6
1.1文献综述 6
1.2关于AD的几种主要假说 7
1.2.1淀粉样蛋白联级假说 7
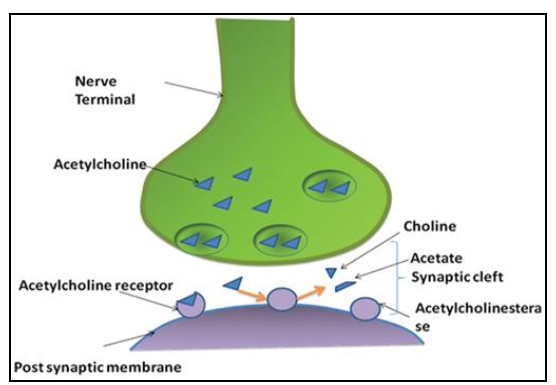
1.2.2 类胆碱能的假说 9
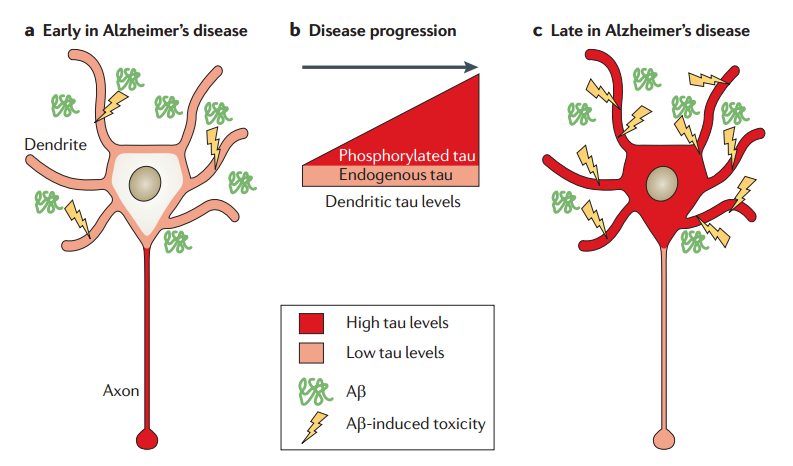
1.2.3 Tau 蛋白假说 10
1.2.4金属离子 11
1.3检测Aβ 寡聚体的各种技术 12
1.4.1正电子放射断层造影术 (PET) 和计算机单光子发射断层扫描 (SPECT) 12
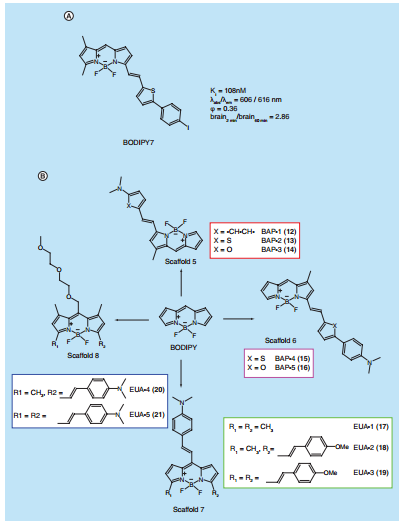
1.3.2 荧光探针 12
第二章 实验方法 16
2.1试剂与仪器 16
2.1.1主要试剂 16
2.1.2主要仪器 16
2.2实验步骤 17
2.3实验内容 18
2.3.1重蒸二氯甲烷 (CH2Cl2) 18
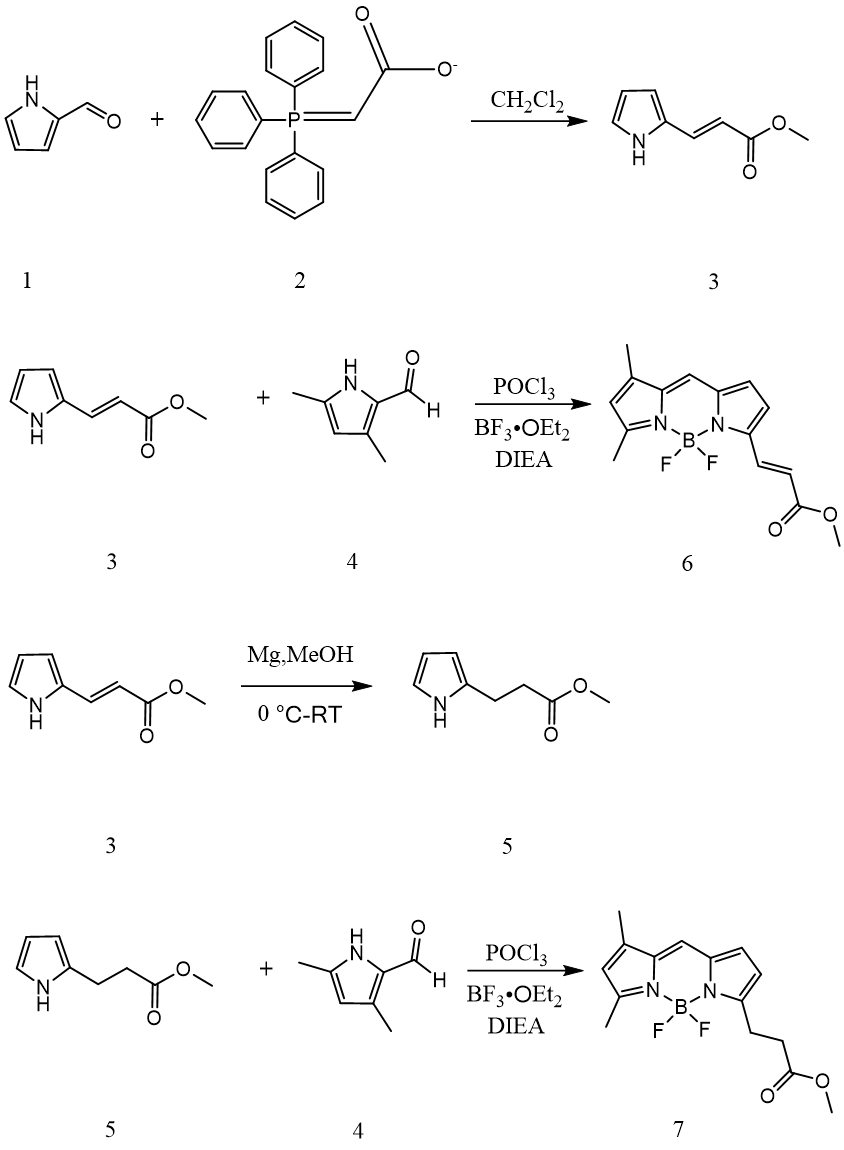
2.3.2制备化合物3 18
2.3.3制备化合物6 19
2.3.4制备化合物5 19
2.3.5制备化合物7 19
2.3.6Aβ40储备液的配置 20
2.3.7化合物6和7的储备液的配置 20
2.3.8化合物6和7与Aβ40的荧光实验方法 20
第三章 结果与讨论 21
3.1化合物3的表征 21
3.2化合物5的表征 22
3.3化合物6的表征 23
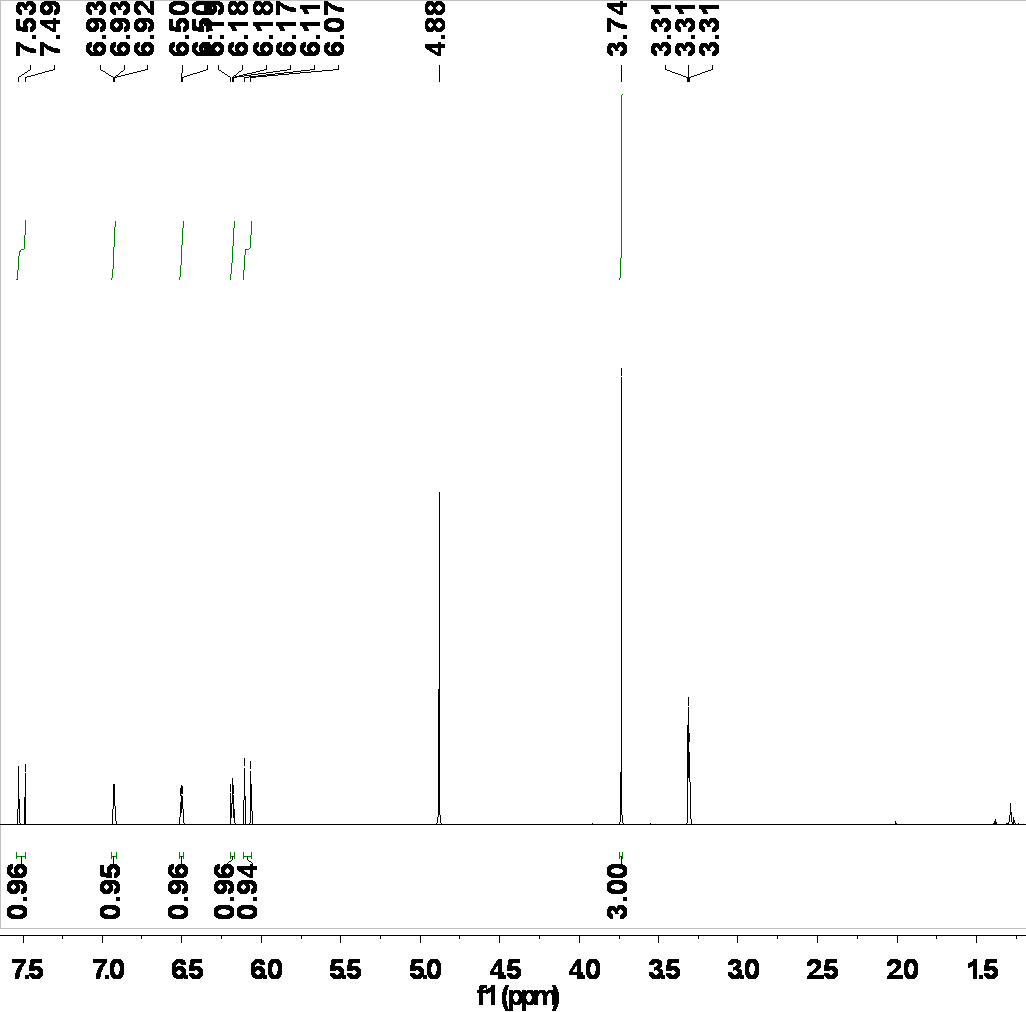
3.3.1核磁共振氢谱图 (1HNMR) 23
3.3.2质谱图 (MS) 24
3.3.3化合物6的吸收光谱 24
3.3.4化合物6 的发射光谱 25
3.3.5化合物6与Aβ40的荧光谱图 25
3.4化合物7的表征 26
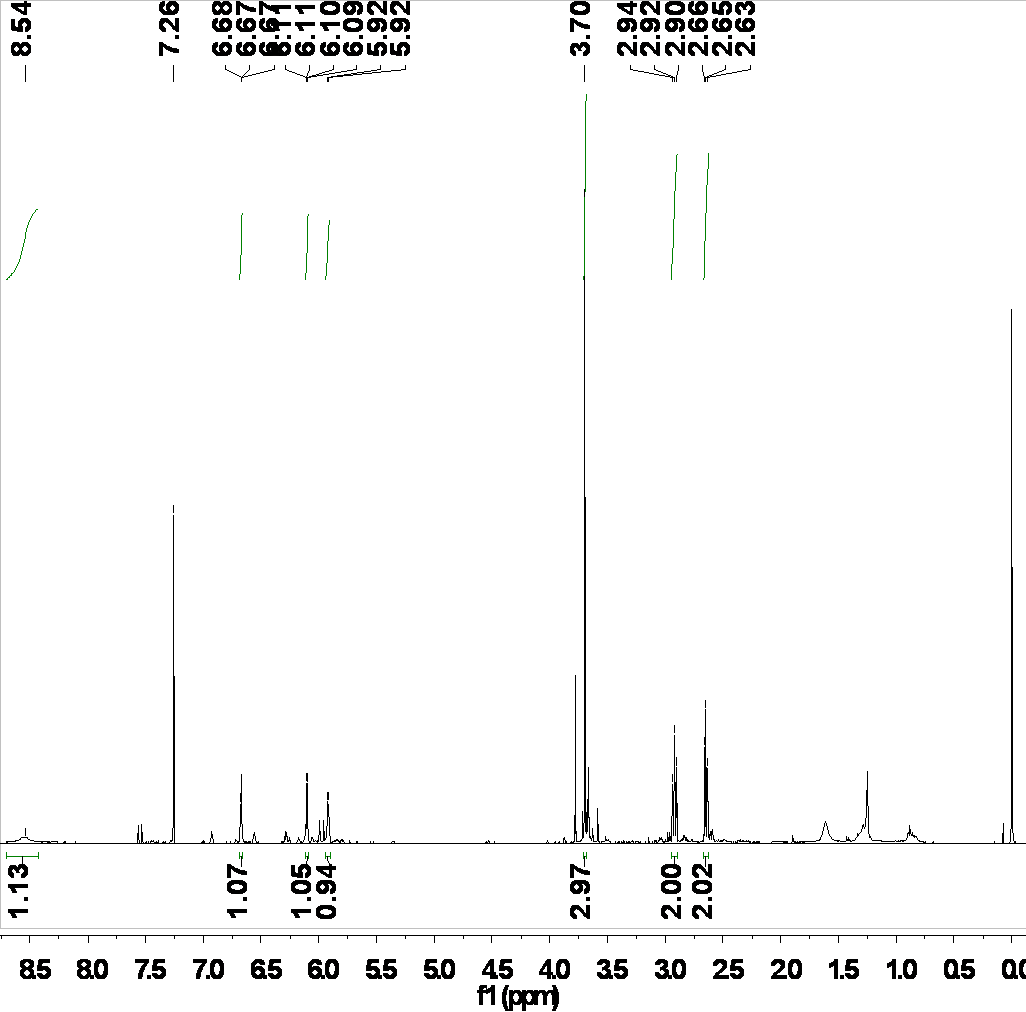
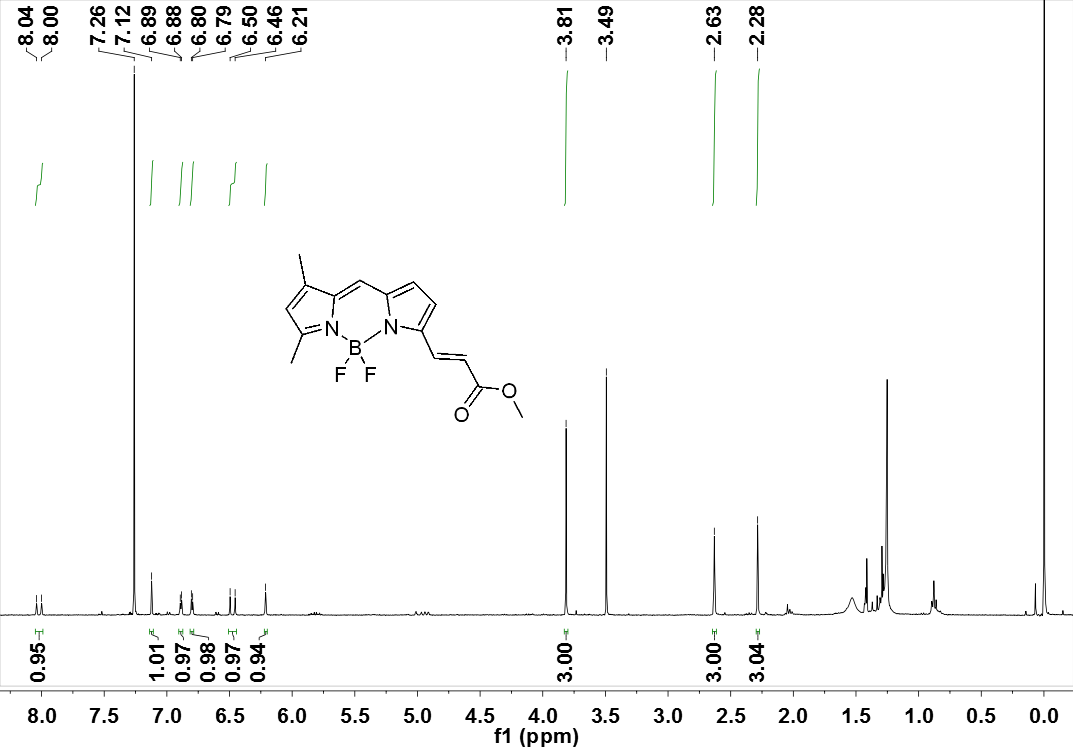
3.4.1核磁共振氢谱图 (1HNMR) 26
3.4.2质谱图 (MS) 27
3.4.3化合物7的吸收光谱 27
3.4.4化合物7的吸收光谱 28
3.4.5化合物7与Aβ40的荧光响应图 28
第四章 结论与展望 29
4.1结论 29
4.2展望 29
参考文献 30
致 谢 33
第一章 绪论
1.1文献综述
阿尔兹海默症 (AD) 最早作为一种神经退行性失调的疾病在1960年被提出[1],神经退行性失调的疾病也是当今世界医疗体系面临的至关重要的问题,而AD就是其中之一。二十一世纪初,神经退行性疾病是老年人中最普遍的形成痴呆症的形式。对比全世界60-80%的痴呆症的案例,在早期阶段,短期记忆丧失是最常见的症状,后来的症状包括思维混乱、情绪波动、语言障碍和长期记忆丧失,渐渐地,受害者失去次要,然后主要身体功能,直到死亡发生[3]。阿尔茨海默症及相关类型痴呆到现在仍然无法完全治疗成功,目前的主要治疗方法只能对中等程度的病症状况有所减轻[2]。AD患者的主要临床表现为记忆力降低、思维能力和语言功能障碍、感知能力下降、方向感缺失、性格改变以及失去独立性等[4],也会伴随出现幻觉、妄想、甚至焦虑、抑郁等症状,这些都已经严重危害到了老年患者的健康与生活品质。
放射显影技术可以对病人发病组织的形态学进行检测,有利于早期AD的临床诊断。核磁共振成像 (MRI) 可以检测出大脑区域内皮层厚度出现阶段性减少的过程,从而推断病人所处的AD的阶段。另一种放射显影技术的发展实现了检出AD病人脑中的病理标志物的目标。将名为PIB的药物注入血管,该药物可穿过血脑屏障 (BBB) 并与淀粉样蛋白β (Aβ) 连接,最终通过正电子放射断层造影术技术 (PET) 检测到[4]。
随着全球老龄化程度的加重,现在全世界有超过3600万患有AD的病患,并且在2030年人数将增加到6500万人,2050年时将超过一亿[2]。当前,AD已成为继心血管疾病、癌症和脑中风之后威胁健康的第四大原因,用于照料患者的总的费用逐年增加,研发治疗该病的治疗药物和手段已成为热点[5]。
1.2关于AD的几种主要假说
1.2.1淀粉样蛋白联级假说
Aβ肽是通过淀粉样蛋白前体蛋白的顺序蛋白水解切割产生的,淀粉样蛋白前体蛋白是一种跨膜糖蛋白,含有短的细胞内C-末端结构域和长的细胞外N-末端[6,7]。APP主要通过两种渠道形成:非致淀粉样蛋白和淀粉样蛋白(F1) [8]。在前者方式中,APP被α-分泌酶切割,释放可溶性N-末端片段(sAPPα)和剩余的C-末端片段 (αCTF)[36]。 γ-分泌酶随后切割αCTF,导致非淀粉样蛋白P3肽(Aβ[17-40]或Aβ[17-42])和APP细胞内结构域的形成。在后一种途径中,APP通过被β-分泌酶和γ-分泌酶切割,主要导致两种淀粉样蛋白肽Aβ40(约90%)和Aβ42(约10%)在细胞外空间形成[9]。两种途径都可以在正常情况下进行,因此,虽然机理仍需进一步研究,但已发现释放的Aβ在健康的大脑中具有一些功能。然而,一旦生产和清除之间的平衡被一些病理因素破坏,肽变得易于聚集,如低pH,缺氧,高胆固醇血症和锌(II)缺乏[10]。通过成核生长机制[11]进行聚集:Aβ的单体或天然未折叠状态缓慢转变为部分折叠状态,进一步聚集形成初始的形态(低聚物),然后形成在延迟阶段称为原始纤维的高阶结构。原纤维通过快速伸长阶段进一步组装成长纤维单体和高级低聚物(F2)。然后,不溶性成熟原纤维沉积在脑实质中形成淀粉样斑块。由于更快的聚集动力学和更好的稳定性,与Aβ40相比,Aβ42是斑块中的主要同种型[10,13]。另外,聚合率可以受到许多因素的影响,包括溶液的pH和离子强度,肽和金属离子或其他外源物种的浓度[6,12]。尽管相对稳定,原纤维仍然可以分解成小的低聚物,充当“储库”。因此,原纤维和低聚物之间存在动态平衡。
以上是毕业论文大纲或资料介绍,该课题完整毕业论文、开题报告、任务书、程序设计、图纸设计等资料请添加微信获取,微信号:bysjorg。
相关图片展示: