一种用于成像神经元细胞和海马组织中NMDA受体附近内源性ONOO-的双光子荧光探针外文翻译资料
2022-08-05 14:52:04

英语原文共 6 页,剩余内容已隐藏,支付完成后下载完整资料
一种用于成像神经元细胞和海马组织中NMDA受体附近内源性ONOO-的双光子荧光探针
摘要
本研究开发了一种用于检测n -甲基- d -天冬氨酸(NMDA)受体附近过氧亚硝酸盐(ONOOminus;)的双光子荧光探针。该探针以萘酰亚胺为基础,包含一个硼酸反应基团和一个作为NMDA受体的靶向单位的ifenprodil样尾。该探针在水溶液中具有较高的灵敏度和选择性,响应时间短。更重要的是,该探针可以与双光子荧光显微镜一起用于检测神经元细胞和海马组织中NMDA受体附近的内源性ONOOminus;。结果表明,该探针有潜力成为研究神经系统ONOOminus;相关疾病的有用成像工具。
1.介绍
过氧亚硝酸盐(ONOOminus;)在各种病理和生理过程中起强氧化剂的作用,是由超氧化物(O2bull;minus;)和一氧化氮(NObull;)的扩散受限反应产生的。许多重要的生物分子,如蛋白质、脂质、核酸和过渡金属酶中心,都被ONOOminus;氧化和破坏。此外,有报道称,许多疾病与ONOOminus;异常相关,包括神经退行性疾病、心血管疾病或炎症性疾病和癌症。n-甲基-d-天冬氨酸(NMDA)受体作为谷氨酸受体和配体门控阳离子通道广泛表达于神经细胞。该受体在控制突触可塑性、兴奋性神经传递以及与记忆相关的大脑发育方面发挥着重要作用。同样,有报道描述了NMDA受体和ONOOminus;之间存在的关系。此外,已经证实神经细胞中ONOOminus;的产生依赖于NMDA受体的激活,并且ONOOminus;可能有助于修饰和调节NMDA受体的功能。此外,ONOOminus;还作为神经退行性疾病,如帕金森病、艾滋病相关痴呆、中风、亨廷顿病和阿尔茨海默病的调节因子。综合观察表明,开发能够监测NMDA受体附近的ONOOminus;的新型成像工具是一个非常理想的目标,这样就可以获得关于ONOOminus;在神经系统中所起作用的更精确的信息。在过去的几十年里,双光子显微术(TPM)利用两个低能量的近红外光子来激发荧光染料从而可以避免光漂白和光损伤而引起了人们的特别关注。最近,一些双光子荧光探针已经被开发出来,用于在活细胞和组织中成像ONOO-。然而,到目前为止,还没有一种荧光探针专门检测NMDA受体附近的ONOOminus;。基于这些问题,在当前的研究中,我们设计、合成并探索了新型双光子荧光探针1用于监测NMDA受体附近的ONOOminus;(方案1)。这种探针包含一个萘酰亚胺基团作为双光子荧光团,一个硼酸基团作为感应ONOOminus;的反应基团,一个作为NMDA受体的靶向单位的ifenprodil样尾。重要的是,大家都知道,ifenprodil是NMDA受体的抑制剂和拮抗剂。在实验中,我们观察到1具有高的水溶性,快速的响应时间,以及对ONOOminus;的高选择性和灵敏度。我们还证明了新的探针可以用于检测活细胞和组织中NMDA受体附近的ONOOminus;。
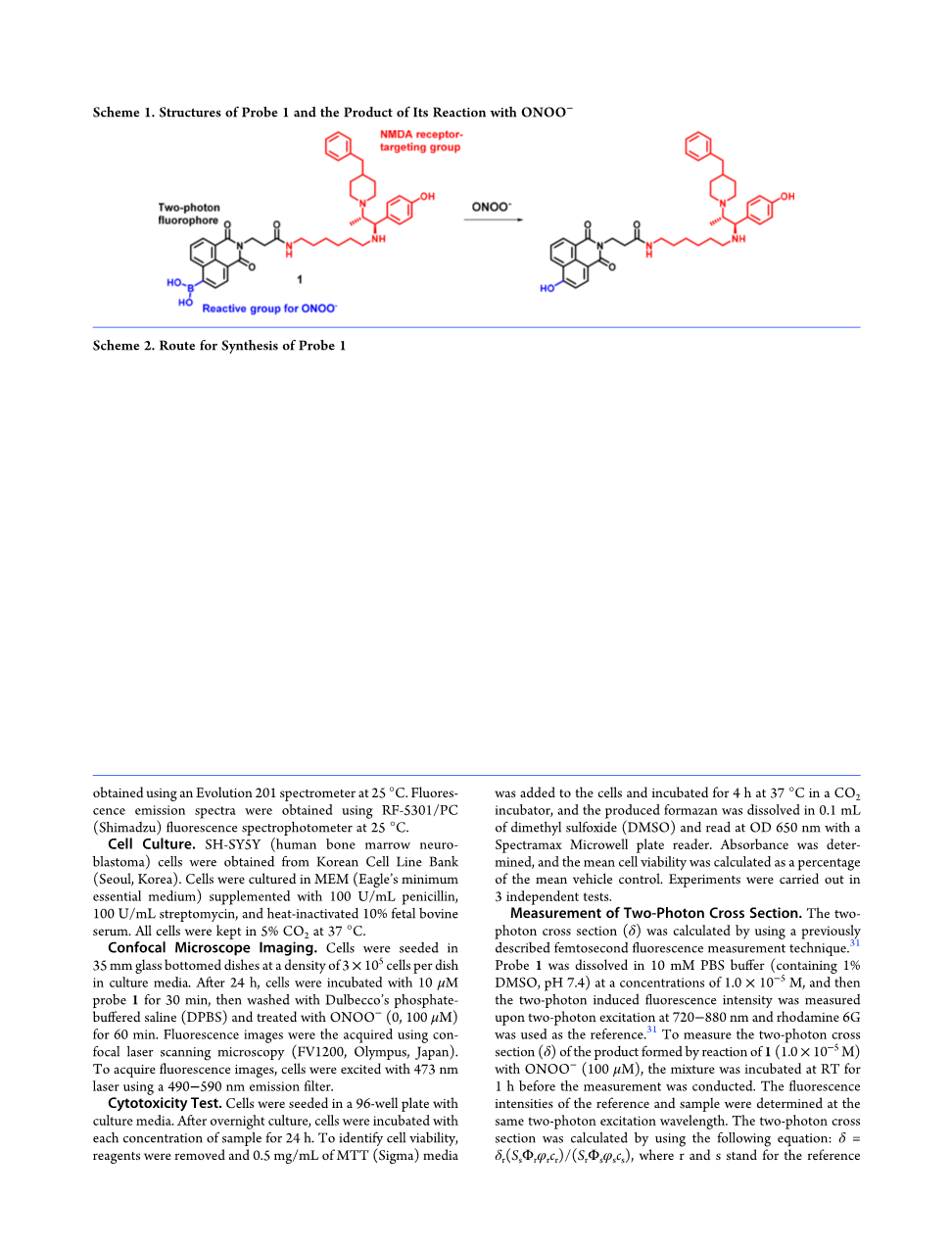
方案1 探针1的结构及其与ONOOminus;反应的产物
方案2 探针1的合成路线
2.实验
2.1.试剂和材料
除非另有说明,化学品均来自商业供应商,未经净化使用。用硅胶(230-400目)进行Flash色谱,用Bruker300MHz记录1HNMR和13cNMR谱。紫外吸收光谱使用Evolution201光谱仪在25℃下获得。使用RF-5301/PC(Shimadzu)荧光分光光度计在25℃下获得荧光发射光谱。
2.2.细胞培养
SH-SY5Y(人骨髓神经母细胞瘤)细胞取自韩国首尔细胞系库。细胞在添加100U/mL青霉素、100U/mL链霉素和热灭活的10%胎牛血清的MEM(Eaglersquo;s minimum essential medium)中培养。所有细胞保存在37℃,5%CO2中。
2.3.共焦显微镜成像
细胞接种于35mm玻璃底培养皿中,密度为3times;105 cells/皿。24小时后,细胞用10mu;M探针1孵育30分钟,然后用Dulbeccos磷酸盐缓冲盐水(DPBS)清洗,并用ONOOminus;(0.100mu;M)处理60分钟。荧光图像使用共聚焦激光扫描显微镜(FV1200,Olympus,Japan)获得。为了获得荧光图像,使用490-590nm发射滤光片,用473nm激光激发细胞。
2.4.细胞毒性测试
将细胞接种于96孔培养皿中。隔夜培养后,将细胞与不同浓度的样品孵育24小时。为了鉴定细胞活力,将试剂去除,将0.5mg/mL的MTT(Sigma)培养基加入细胞中,37°C CO2培养箱孵育4h,用0.1mL二甲亚砜(DMSO)溶解,用Spectramax微孔读卡器在OD值650 nm处读出。测定吸光度,计算平均细胞存活率作为平均对照的百分比。实验分为3个独立的试验。
2.5.双光子截面的测量
用先前描述的飞秒荧光测量技术计算了两光子截面(delta;)31探针1溶解于浓度为1.0times;10minus;5 M的10m MPBS缓冲液(含1% DMSO,pH 7.4)中,在720~880 nm双光子激发下,以罗丹明6G作为参比,测量双光子诱导荧光强度。为了测量1(1.0times;10-5 M)与ONOOminus;(100mu;M)反应形成的产物的双光子截面(delta;),混合物在室温下孵育1小时后进行测量。在相同的双光子激发波长下,测定参比和样品的荧光强度。双光子截面的计算公式为:,其中r和s代表参考分子和样品分子,S为CCD测得的信号强度,为荧光量子产率,为实验仪器测得的总体荧光采集效率,c为溶液浓度,为文献报道的标准物质双光子截面值。
2.6.双光子荧光显微镜
用光谱共焦和多光子显微镜(Leica-TCS-SP8-MP)对探针1标记的细胞和组织进行TPM成像,物镜为times;10干(NA,0.30)和times;40油(NA,1.30)。图像采集采用锁模钛-蓝宝石激光光源(迈泰HP;光谱物理,脉频80 MHz,脉宽100 fs)设定波长750 nm,输出激光功率2670 mW,焦面处约为15 mW。在500~600 nm范围内捕捉TPM图像;在400 hz扫描速度模式下,使用内部PMTs在8位无符号512times;512像素条件下获取信号。
2.7.新鲜大鼠海马切片的制备及染色
取两周龄大鼠(SD),制备海马切片。用人工脑脊液(ACSF、124mM NaCl、3mM KCl、26mM NaHCO3、1.25mM NaH2PO4、10mM D-glucose、2.4mM CaCl2、1.3mM MgSO4)制成冠状切片(400mu;m厚)。切片用20mu;M 探针1在之前在5%CO2和95% O2的条件下发泡的ACSF中孵育50分钟,37℃,然后用ACSF反复洗涤。探针1标记的切片被转移到成像盘(玻璃底盘,MatTek),并在光谱共焦多光子显微镜中观察。分别用50mu;M SIN-1、100mu;M艾芬地尔和150mu;M ifenprodil处理20、30和50min,观察SIN-1、艾芬地尔和ifenprodil的作用。
结果与讨论
3.1.合成
探针1采用方案2所示的路线合成,首先是4-溴-1,8-萘酸酐和双(pinacolato)二硼的Suzuki偶联形成硼酸盐3。用beta;-丙氨酸处理3得到羧酸4。用上述方法合成的芬丙地尔衍生物2 12,19与4在羟基苯并三唑(HOBt)/1-乙基-3-(3dimethylaminopropyl)碳二亚胺(EDC)存在下反应得到1。探针1和所有合成中间体的结构通过1H NMR、13C NMR和ESI质谱(见支持信息)进行了表征。
3.2.光学性质
UV / vis吸收和荧光变化在磷酸盐缓冲盐水溶液(pH 7.4, 0.1 M PBS,含1% DMSO)中进行检测,在PBS中添加探针1(10mu;M)和各种活性氧(ROS)和氮物种(RNS)(100mu;M),包括ONOOminus;,过氧化氢,N Obull;OClminus;,bull;OH,ROObull;,叔丁基过氧化物(TBHP),如图1所示,探针1在350 nm处有紫外/可见吸收达到最大值,在550 nm处有微弱荧光(450 nm激发)。添加ONOOminus;可导致吸收峰从350 nm红移至450 nm, 550 nm处的荧光强度显著增加(图2)。重要的是,探针1相较于其他ROS和RNS 对于ONOOminus;显示出高选择性,其检出限为1.84times;10minus;7 M(图S11)。此外,还测定了在PBS缓冲溶液(pH 7.4, 10 mM,含1% DMSO)中1的双光子(TP)作用谱以及1与ONOOminus;反应的产物。在750 nm处,双光子作用截面()值约为1.0 GM。探针1相较于其他ROS和RNS 对于ONOOminus;显示出高选择性,其检出限为1.84times;10minus;7M(图3)。这一结果表明,当1与ONOOminus;反应时,双光子激发荧光(TPEF)强度增加了4.0倍。根据之前的报告,在方案S1.32minus;35中显示了probe与ONOOminus;反应的机理:首先ONOOminus;添加到硼酸基团,随后水解形成相应的苯酚。1与ONOOminus;反应后的FAB-MS数据支持了这一猜测(图S14)。. 在m/z=691. 3857处观察到[M H] 的峰,[M Na] 在m/z=713.3723处观察到峰,与反应后预测产物的分子量相匹配。据报道,硼酸基团与ONOOminus;的反应速度比与其他氧化基团的反应快得多。ONOOminus;的硼酸盐氧化速率常数被计算为约106 Mminus;1 sminus;1。这种高反应性使探针1成为ONOOminus;的选择性荧光探针。
图1. (a)不同ROS和RNS (100mu;M)的探针1(10mu;M)在PBS溶液(pH 7.4,含1% DMSO)中的紫外/可见吸收光谱和(b)荧光光谱;lambda;ex= 450 nm,狭缝3 nm times; 3 nm。
图2. 荧光滴定探针1 (10 mu;M)在PBS溶液(pH 7.4,含1% DMSO)中加入ONOOminus;(0 ~ 10 equiv);lambda;ex= 450 nm,狭缝3 nm times; 3 nm。
图3. 在PBS缓冲液(10 mM,含1% DMSO, pH 7.4)中加入ONOOminus;(10 equiv)之前(黑色)和之后(红色)探针1 (10 mu;M)的双光子作用谱。双光子作用截面值()的测量不确定度约为plusmn;15%。
3.3.活细胞中的单光子荧光成像
对探针1在活神经母细胞瘤细胞(SH-SY5Y)中成像ONOOminus;的效用进行了评估。如图4所示,当SH-SY5Y细胞与探针1 (10 mu;M)孵育30分钟时,膜发出微弱的荧光。此外,当细胞再与100 mu;M ONOOminus;孵育60分钟时,探针1在细胞膜上的荧光强度显著增强。这些结果表明,1可用于检测细胞膜上NMDA受体附近的ONOOminus;。为了检测探针1对SH-SY5Y细胞的细胞毒性,将不同浓度的探针1与细胞孵育24 h,采用MTT法检测细胞活性。如图S15所示,50 mu;M
剩余内容已隐藏,支付完成后下载完整资料
资料编号:[261756],资料为PDF文档或Word文档,PDF文档可免费转换为Word




