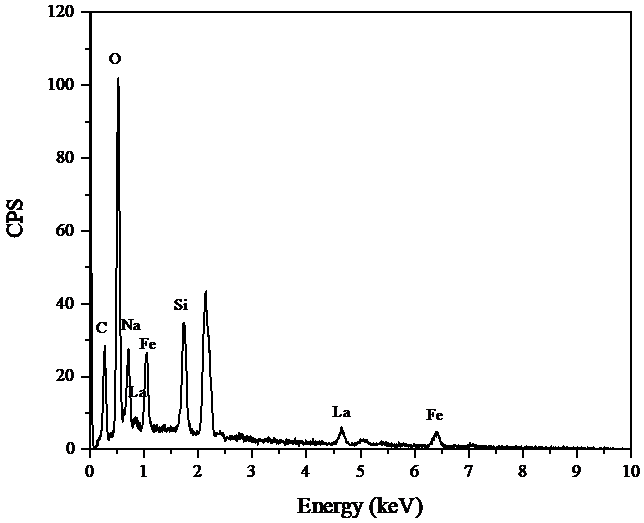FeLa氧化物微球吸附水中砷的研究毕业论文
2020-02-19 15:21:32
摘 要
本研究尝试制备一种Fe3O4@La2O3磁性空心纳米微球吸附剂,即在纳米SiO2球表面先后负载Fe3O4和La2O3,再以NaOH溶解SiO2,形成磁性氧化物空心微球用来脱除水中砷。对Fe3O4@La2O3磁性空心纳米微球吸附剂进行了SEM、EDS、XRD、FTIR和磁性表征,对其吸附水中As(V)进行了pH值、吸附剂投加量、吸附时间、初始浓度等因素的影响研究,进行了吸附动力学、等温线和热力学分析,并利用FTIR和XPS等技术对吸附机理进行了探究。得到以下结果:
(1)对制备得到的材料进行了SEM表征证实其为空心微球,微球直径为200 nm,XRD、FTIR表征发现吸附剂由Fe3O4和La2O3复合组成,磁滞回线表征发现纳米微球表现出磁性,证实成功制备得到了Fe3O4@La2O3磁性空心纳米微球吸附剂。
(2)对Fe3O4@La2O3磁性空心纳米微球吸附剂脱除水中As(V)研究表明在pH值为4.0,25℃下吸附符合准一级动力学模型和Langmuir等温模型,最大吸附量为31.42 mg/g;对吸附热力学进行表征发现,磁性纳米微球在40℃时吸附效果最好,且等温吸附符合Freundlich模型,实验最大吸附量达到53.36 mg/L。
(3)FTIR和XPS机理分析发现,Fe3O4@La2O3磁性空心纳米微球对As(V)的吸附过程中,吸附剂表面-OH被H2AsO4-替换,Fe3 、La3 浸出与H2AsO4-进行配位反应生成砷酸盐沉淀,二者协同除砷。且吸附之后的纳米微球也表现出磁性,易于磁场分离。
关键词:As(V)的吸附;铁氧化物;镧氧化物;空心微球
Abstract
In this study, an Fe3O4@La2O3 magnetic hollow nano-microsphere adsorbent was prepared, that is, the surface of Nano-SiO2 ball was loaded with Fe3O4 and La2O3, and then NaOH dissolved SiO2 to form magnetic oxide hollow microspheres used to remove arsenic from water. SEM, EDS, XRD, FTIR and magnetic characterization of Fe3O4@La2O3 magnetic hollow nano-microsphere adsorbent were carried out, and the effects of As(V) on pH value, adsorbent addition, adsorption time and initial concentration in adsorption water were studied, and adsorption kinetics, isotherm and thermodynamic analysis were carried out. The adsorption mechanism was explored by using FTIR and XPS techniques. The following results are obtained:
(1) SEM characterization of the prepared material confirmed that it was a magnetic hollow nano-microspheres, the microsphere diameter of 200nm, XRD and FTIR showed that the adsorbent was composed of Fe3O4 and La2O3, and the magnetic hysteresis line characterization found that the nano-microspheres showed superparamagnetism, It is proved that Fe3O4@La2O3 magnetic hollow nano-microsphere adsorbent was successfully prepared.
(2) The removal of As(V) from water in the Fe3O4@La2O3 Magnetic hollow nano-microsphere adsorbent shows that the adsorption is consistent with the quasi-primary kinetic model and the Langmuir isothermal model under the pH 4.0, 25℃, and the maximum adsorption amount is 31.42 mg/g The characterization of adsorption thermodynamics shows that the adsorption effect of magnetic nano-microspheres in 40℃ is the best, and the isothermal adsorption conforms to the Freundlich model, and the maximum adsorption amount of the experiment reaches 53.36 mg/L.
(3) FTIR and XPS mechanism analysis found that Fe3O4@La2O3 magnetic hollow nano-microspheres in the adsorption process of As(V), adsorbent surface -OH was replaced by H2AsO4-, Fe3 , La3 leaching and H2AsO4- coordination reaction to produce arsenic acid precipitation, the two coordinated arsenic removal. And the nano-microspheres after adsorption also show superparamagnetism, easy to separate from magnetic field.
Key words: As(V) adsorption; iron oxide; lanthanum oxide; hollow microsphere
目录
第一章 绪论 1
1.1砷的概述 1
1.1.1砷的性质与来源 1
1.1.2水体砷污染现状 2
1.2除砷技术研究进展 2
1.2.1沉淀法 3
1.2.2离子交换法 3
1.2.3膜分离法 3
1.2.4电解法 3
1.2.5吸附法 3
1.2.6生物法 4
1.3砷吸附材料 4
1.3.1砷吸附材料介绍 4
1.3.2铁处理As(Ⅴ)的研究进展 5
1.3.3镧处理As(Ⅴ)的研究进展 5
1.4吸附理论及模型介绍 6
1.4.1吸附量 6
1.4.2吸附动力学 6
1.4.3吸附热力学 7
1.5研究的目的与意义 8
1.6研究内容与技术路线 8
1.6.1研究内容 8
1.6.2技术路线 9
第二章 实验材料与研究方法 10
2.1实验试剂与仪器设备 10
2.1.1实验试剂 10
2.1.2实验仪器 10
2.2砷的检测方法 11
2.2.1显色原理 11
2.2.2显色剂的配制 12
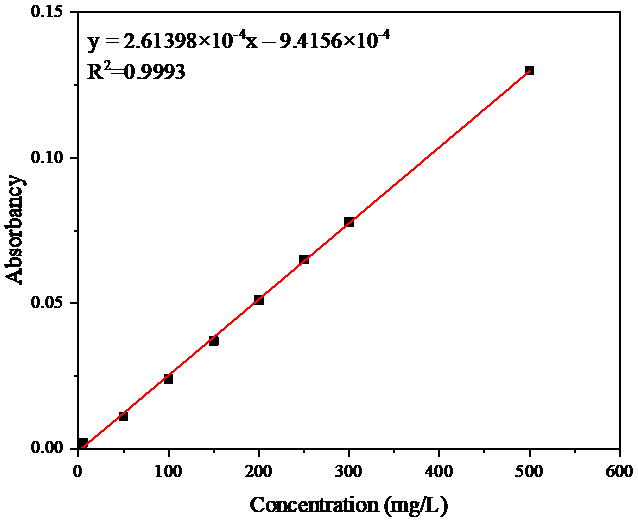
2.2.3标准曲线的绘制 12
2.2.4 砷含量测定 14
第三章 吸附材料的制备与表征 15
3.1 SiO2球的制备 15
3.2 SiO2@Fe3O4球的制备 15
3.3 Fe3O4@La2O3磁性空心纳米微球的制备 15
3.4吸附材料的表征与结果分析 15
3.4.1 SEM 15
3.4.2 EDS 16
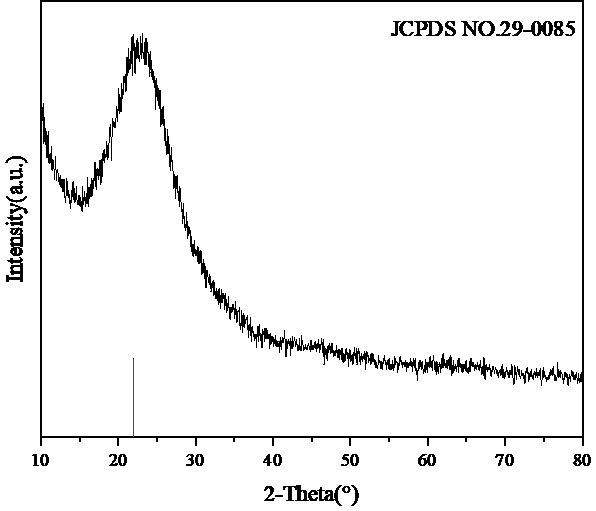
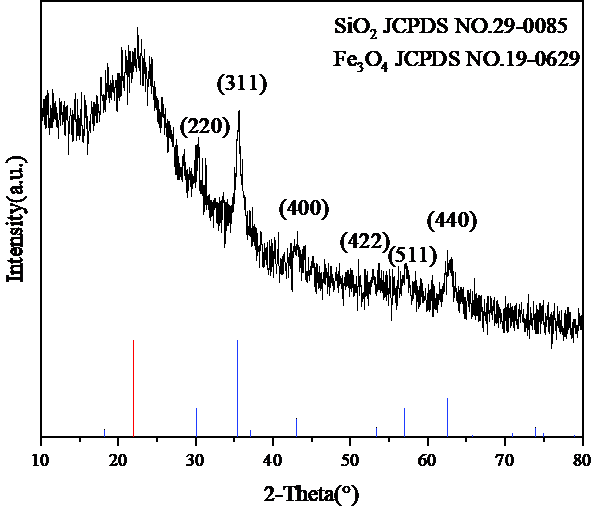
3.4.3 XRD 17
3.4.4 FTIR 19
3.4.5磁滞回线 20
第四章 Fe3O4@La2O3磁性空心纳米微球吸附As(V)的性能 22
4.1 pH值对吸附As(V)性能的影响 22
4.2 吸附剂投加量对吸附As(V)性能的影响 24
4.3 吸附动力学 25
4.4吸附热力学 26
4.4.1吸附等温线 26
4.4.2温度对Fe3O4@La2O3磁性空心纳米微球吸附As(V)的影响 27
第五章 Fe3O4@La2O3磁性空心纳米微球吸附As(V)的机理 30
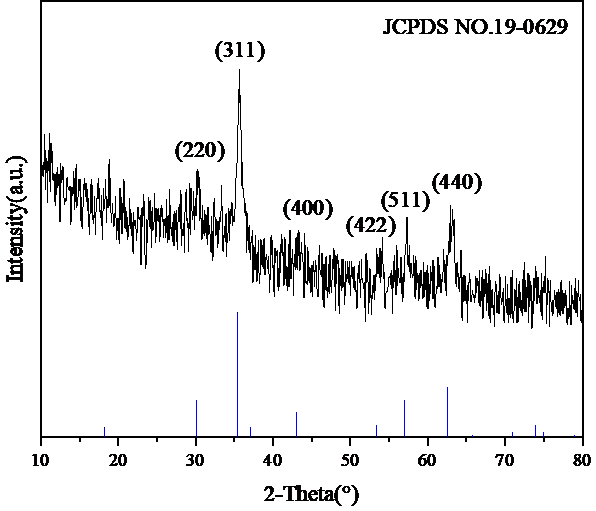
5.1XRD分析 30
5.2 FTIR分析 31
5.3 XPS分析 32
5.4吸附后的磁滞回线 36
第六章 结论和展望 37
6.1结论 37
6.2展望 37
参考文献 38
致谢 41
第一章 绪论
1.1砷的概述
1.1.1砷的性质与来源
砷元素,符号为 As,是一种毒性很强的、介于金属元素和非金属元素之间的过渡元素,也是地壳中最常见元素中的第20位元素。砷元素的毒性与其价态、存在形态和化合物溶解度有着极为密切的关系。在价态上,砷主要有四种(±3、0、 5), As5 的毒性明显小于As3 ,毒性相差约60倍[1,2];在存在形态上,无机砷的毒性远比有机砷剧烈,毒性相差约100倍[3];在溶解度上,单质砷溶解度小,毒性也不大[1,4]。单质砷在自然界中出现极少,大多与硫、氧、铁等结合作为硫化物、氧化物、水合物及含氧阴离子[5]。无机砷(大多为亚砷酸盐和砷酸盐),无论是对人类还是植物来说毒性都极大,而这两种无机态的砷也是砷元素分别在还原性、氧化性水体中的主要存在形式[6]。
在自然界(土壤、岩石、水体、大气和生物体)及人类活动(工业如颜料、燃料、防腐剂等;农业如化肥、饲料、除草剂等)中,到处有砷的存在。这也表明了砷的主要来源为自然和人为因素。一方面,砷在自然界中有许多硫化物,如As2S2(雄黄)、As2S3(雌黄)、As2O3(信石,也叫砒石)和FeAsS(砷黄铁矿)等[7]。这些含砷矿石在自然作用(如火山爆发、岩石风化、荒地火灾等)下成为将砷引入环境的主要来源[8]。另一方面,人类在工业上利用砷及含砷金属和原材料进行一系列冶金、制造等行为均有可能导致含砷“三废”的产生[9];在农业上,砷会随着一些除草剂、杀虫剂等的使用而直接排放到环境中,在土壤中累积,慢慢渗入地下水,进入水循环系统[10,11]。比较这两个将砷引入自然环境的影响因素,全球每年由于自然作用和人为活动排入水环境的砷分别约为2.2万t和120万t[12], 人为活动使砷加入循环的量远比由自然发生引起的高[13],故人为因素占主体地位。
砷元素不是人体所必需的营养元素,但是却是构成人类、动植物的要素之一,原因归咎于所处环境中含有砷[14]。原本在自然界中少量的砷元素不会对人体产生危害,可一旦砷元素在人体内过量累积,则会引起砷中毒[15]。砷可以通过饮、食、呼吸等方式进入人体,引起急性和慢性砷中毒。急性砷中毒需要立即就医,这种情况通常由误食高含量的砷或自杀行为引起,如摄入了受砷污染的食物、饮料或含砷农药[14]。由急性砷中毒引起的早期表现主要包括口腔和咽喉的灼热和干燥,语言障碍,腹部绞痛,呕吐,大量腹泻和血尿。由于脱水,肌肉痉挛,面部水肿和心脏异常,休克会迅速发生[16]。慢性砷中毒主要影响到人的呼吸、胃肠、心血管、神经和造血系统。它可能导致食欲不振,恶心呕吐,口舌干燥,神经衰弱,手脚麻痹等。长时间接触会导致手掌、脚掌的皮肤干燥、角质变暗和湿疹,毛发掉落,指甲变脆等[17]。而一般情况下慢性砷中毒占大多数,且症状在短时间内难以显现,为了保护人体健康,控制饮用水中砷含量是当务之急,故应高度重视水体中砷污染的问题。
一次性摄入0.07-0.2 g的砷会致使人急性中毒,摄入0.1-0.3 g可致人死亡[18]。每人每天通过食物、饮用水摄入的砷分别不能超过0.3 mg、0.2 mg。鉴于单人单日饮水约2-3 L, 因此0.05 mg/L成为各国制定的饮用水最高允许含砷浓度标准[19]。
世界卫生组织WHO对国际饮用水标准中砷含量的规定不断降低,1958年为0.2 mg/L,1963年降到0.05 mg/L,直到1992年降为0.01 mg/L。欧盟、美国也分别于2003年、2006年发布了相同标准。2007年,我国发布的新的饮用水砷标准为0.01 mg/L。
1.1.2水体砷污染现状
地下水砷污染问题致使全人类暴露于饮用水受污染的危险之中,极大程度上的威胁着人类的健康,水体砷污染已成为了一个世界性的问题。目前世界上已超过70个国家被划归为有地下水砷污染问题的范围内,包括发达国家如美国,发展中国家如中国、孟加拉国、印度、缅甸、巴基斯坦、越南、尼泊尔、柬埔寨等[20],其中所受污染最为严重的要数孟加拉国、印度、柬埔寨和越南[21]。据估计,全世界范围内受到砷污染地下水带来的不利影响的已超过1.5亿人口[22],正面临因砷污染带来的癌症和其它相关疾病威胁的至少有1亿人口[23]。
湄公河三角洲地区百年来过量开采地下水,导致原本蕴藏在地下的砷纵向迁移,柬埔寨的砷浓度范围为1-1610 μg/L(平均值为217 μg/L),越南南部的砷浓度范围为1-845 μg/L(平均值为39 μg/L)。调查显示,砷可从长期饮用受砷污染地下水人群的毛发中检测出来,截止至2010年约300万人受到影响[24]。
在西孟加拉地区,地下水砷含量范围为50-3700 μg/L(平均值为200 μg/L),不仅饮用水受到污染,谷物和蔬菜由于吸收了砷污染地下水,砷含量日渐累积,波及到了食物链。约占总数44%的人口患有砷相关疾病,如结膜炎,黑变病,角化过度和色素沉着过度[25]。
2006年9月,湖南省岳阳县新墙河流入来自上游化工厂日常性排放的大量高浓度含砷废水,造成砷超标10倍左右,8万居民因饮用水源地遭受污染而用水困难[26]。
2007年12月, 贵州省独山县都柳江上游河道流入某硫酸厂非法生产排放的大量含砷废水,造成附近十余名村民轻微中毒 ,并造成下游70 km外的三都水族自治县县城水厂被迫停水,2万多人面临饮用水安全的威胁[27]。
2009年7月,山东沂南涑河流入含砷量超标2.7254万倍的有毒废水,原因是某化工公司非法生产并将生产过程中产生的大量含砷废水蓄意隐藏,趁当地降雨非法排放,严重污染水体[28]。
1.2除砷技术研究进展
目前,去除水体中的砷的方法主要可以分为这几类:化学类有沉淀法、物化类有离子交换法、膜分离法、电解法、吸附法,生化类有生物吸附法[29]。
1.2.1沉淀法
沉淀法在废水处理中的应用十分普遍,是去除重金属离子的常用方法,同时也是国内外去除废水中砷的主要的化学方法,其除砷原理为水中的砷与沉淀剂反应形成砷酸盐或硫化物从而沉淀下来,过滤后从水中分离。目前中和沉淀法、混凝沉淀法和硫化物沉淀法这三种方法发展较为成熟[30],常用钙、铁、铝盐和硫化物作沉淀剂。沉淀法具有工艺简单,投资低的优点,较适合处理高浓度含砷废水,但该方法需要投入大量的沉淀剂并产生大量的废渣,其最终产物的处理将成为二次污染隐患方面的另一道难题。
1.2.2离子交换法
以上是毕业论文大纲或资料介绍,该课题完整毕业论文、开题报告、任务书、程序设计、图纸设计等资料请添加微信获取,微信号:bysjorg。
相关图片展示: