表面活性剂对电极材料在水溶液中稳定性的影响毕业论文
2020-04-15 17:45:20
摘 要
近年来,电池技术的研究发展主要集中在小型应用上,例如便携式电子设备和车用电池,这对能量密度和比容量提出了很高的要求。但这些技术并未广泛用于电网的大规模储能上,主要是因为其制造成本过高。安全、低价且环境友好的水溶液电池逐渐作为新型二次电池被研究,例如锂离子电池、钠离子电池、钾离子电池和锌离子电池等。不同于传统金属离子电池,以NH4 为电荷载体的铵根离子电池也表现出新的储能潜力。但目前铵根离子电池报道较少,开发高倍率、长循环寿命的正极材料是进一步发展铵根离子电池的关键。本实验选取铁氰化镍(NiHCF)作正极材料,其在(NH4)2SO4电解液中表现出来优异的容量和倍率性能,优于已报道的嵌铵正极材料:在150m A/g的电流密度下比容量约为57 mAh/g,在2400 mA/g电流密度下容量保留率为57.9%。然而在3000次循环后仅有65.5%的容量保留率。为了提高材料的长循环稳定性,在电解液中引入表面活性剂十二烷基硫酸钠(SDS)。结果表明NiHCF的循环性能得以提高,具有80.3%的容量保留率,这是因为SDS分子通过静电吸附吸附在电极表面上,抑制了氢的释放。在加入另一种表面活性剂聚乙二醇(PEG-400)的(NH4)2SO4电解液中其循环性能并未提高。
关键词:铵根离子电池 普鲁士蓝类化合物 表面活性剂
Effect of Surfactant on the Stability of Electrode Materials in Aqueous Solution
Abstract
In recent years, the research and development of battery technology mainly focus on small applications, such as portable electronic devices and automotive batteries, which put forward high requirements for energy density and specific capacity. But these technologies are not widely used for large-scale energy storage in power grids, mainly because of their high manufacturing costs. Safe, low-cost and environmentally friendly aqueous batteries, such as lithium ion batteries, sodium ion batteries, potassium ion batteries and zinc ion batteries, are gradually being studied as new secondary batteries. Different from traditional metal-ion batteries, ammonium-ion batteries with NH4 as charge carriers also show new energy storage potential. However, there are few reports on ammonium-ion batteries so far, and designing cathode materials with high rate and long cycle life is the key to the further development of ammonium-ion batteries. In this experiment, nickel hexacyanoferrate (NiHCF) was selected as the cathode material, which shows excellent capacity and rate performance in (NH4)2SO4 electrolyte, and outperforms the reported ammonium-ion intercalation cathode materials: the discharge capacity of 57 mAh/g at 150 mA/g, capacity retention of 57.9% at 2400 mA/g. However, after 3000 cycles, there is only 65.5% capacity retention. To improve the long cycling stability of NiHCF, sodium dodecyl sulfate (SDS) was introduced into the electrolyte. The results show that the cycle performance of NiHCF is improved with a capacity retention of 80.3%, because the SDS molecules are adsorbed on the electrode surface by electrostatic adsorption, inhibiting the release of hydrogen. The cycle performance is not improved as another surfactant: polyethylene glycol (PEG-400) is added into (NH4)2SO4 electrolyte.
Key Words: Ammonium-ion battery; Prussian blue; Surfactant
目 录
摘 要 I
Abstract II
第一章 前言 1
1.1 引言 1
1.2 新型二次电池及其关键材料 1
1.2.1 金属离子电池 1
1.2.2 铵根离子电池 3
1.2.3 普鲁士蓝类化合物 3
1.3 表面活性剂在电池中的应用 4
1.3.1 表面活性剂在制备电池材料中的应用 4
1.3.2 表面活性剂对电解液的影响 5
1.4 本论文的研究内容和意义 5
第二章 实验部分 7
2.1 实验试剂 7
2.2 实验仪器 7
2.3 铵根离子电池正极的制备 8
2.3.1活性物质NiHCF的合成 8
2.3.2 铵根离子电池正极极片的制作 8
2.4 活性物质NiHCF的物理表征 9
2.4.1 形貌表征 9
2.4.2 热稳定性表征 9
2.4.3 X射线衍射表征 9
2.4.4 傅里叶转换红外线光谱测试 9
2.5 电化学性能测试 10
2.5.1 未添加表面活性剂 10
2.5.2 添加SDS表面活性剂 10
2.5.3 添加PEG-400表面活性剂 11
第三章 结果与讨论 12
3.1 NiHCF的制备方法 12
3.2 NiHCF的物理表征结果 12
3.3 NiHCF的电化学性能 14
3.4 加入SDS后的电化学性能 16
3.5 加入PEG-400后的电化学性能 18
3.6 各电池体系的阻抗分析 19
第四章 结论与展望 20
4.1 结论 20
4.2 展望 20
参考文献 21
致谢 25
第一章 前言
1.1 引言
工业革命的核心,其实就是能源转换的革命,迄今为止,一共发生过两次世界工业革命和三次能源革命[1]。在已发生的两次世界工业革命中,能源更替是其主要的诱导因素,在每一次工业革命发生之前,必然会有一次主流能源的变化[1]。日前,工业化快速发展带来了化石能源日益减少的危机,以及环境污染越发严重等问题,中国作为世界能源消费大国,在新一轮的能源革命中,也面临着机遇和挑战[1]。优化能源结构、快速发展清洁、高效、低碳的新型能源以代替传统化石能源,才能在即将到来的工业革命中占领先机[1]。
1991年以后,SONY公司总结前人成果,以LiCoO2为正极材料,以石墨为负极材料,终于把锂离子电池推广到商用。锂离子电池因为能量密度高、输出电压高、充电效率高、循环性能优异等优点[2],已被广泛应用于电子产品、储能、交通工具、航空航天、军事等方面。但作为智慧能源的雏形,锂离子电池在今后的发展中急需解决一些问题,如:高成本、不耐过充过放等问题。所以,越来越多的科学家将目光转向了以钠离子电池为主的新型二次电池的研究中,各种新型二次电池被研发应用。
1.2 新型二次电池及其关键材料
水溶液可充电电池由于其高安全性、低成本和环境友好性而引起了海内外大量科学家的研究兴趣。大量金属离子被尝试作为电荷载体研发新型二次电池,如钠离子电池、锌离子电池、铝离子电池等。也有科学家聚焦于铵根离子电池的研究中,但是研究还处于起步阶段。
1.2.1 金属离子电池
钠离子电池的发展基本与锂离子电池同步,但由于其质量较重,在充放电过程中难以脱嵌,且主体材料的形变会导致钠离子晶体结构的损坏,导致电池的循环稳定性极差[3]。水溶液电池体系解决了以上的一些问题。钠离子的水合离子半径略小于锂离子的,其移动速率更快;水溶液离子电导率比有机电解液高2个数量级,在此基础上,大尺寸的电极也能具有较高的库仑效率和能量密度[4];与此同时,水溶液电池解决了电池的安全问题,并且制作成本更低。然而,将钠离子电池投入实际应用中还有一些困难:(1)由于水的电化学稳定窗口较窄,水溶液钠离子电池的电极材料种类较少[4];(2)水溶液电解液与电极材料多种副反应影响了电池的可逆性;(3)亟待提高电极材料在水溶液中的循环稳定性[4]。
锌离子电池除了具有高能量密度特征之外,还具有高功率密度,可计算出其功率密度最高可达12 kW/kg, 锌离子电池能量密度最高可达320 Wh/kg,大约是超级电容器的15倍[5]。另外,锌离子电池的的制造成本低廉,对制造环境没有过多的要求,且锌的资源丰富,其价格是除铁之外最便宜的[5]。但是锌离子电池也存在不少硬伤:(1)锌的热力学性质活泼[6],且在电池充放电过程中,锌离子在金属锌表面反复溶解和沉积,从而形成锌枝晶[7]。(2)由于放电直接生成了难溶性ZnO或Zn(OH)2等阳极产物覆盖在电极表面,阻止了锌的正常溶解,使锌电极的反应表面积减少,电极变为“钝态”[7]。
铝离子电池在电化学充电/放电反应期间有三个电子转移,相对于单电子锂离子电池的存储容量更具有竞争性[8]。此外,由于其较低的反应性和易于处理,这种铝离子电池可能比锂离子电池平台节省成本和高安全性[9]。因为其在低电流密度下具有高的理论容量和总的比能量,铝作为铝空气电池中的阳极长期受到关注[10]。但是,在水溶液电解质中铝阳极的析氢反应限制了水溶液铝离子电池的发展,由于在电解质中铝的高腐蚀和析氢,可靠的电可充电铝/空气电池被认为不可能使用水溶液电解质,因为这会导致阳极效率的急剧降低[11]。此外,一些研究表明,在水介质铝空气电池中,氧化铝膜覆盖铝阳极的表面,这降低了阳极电压和电池效率。另外,铝的电沉积/电剥离的困难很大程度上限制了电解液的选择[12,13]。一些研究表明,铝离子的能量密度和功率密度还受到阴极材料的限制[14]。同时,为了抑制铝枝晶的生长,传统的聚合物粘结剂和分离剂并不满足当前的需求[15]。
1.2.2 铵根离子电池
2017年,第一个“摇椅式”铵根离子电池的全电池结构被报道。它采用铵离子普鲁士白类似物(NH4)1.47Ni[Fe(CN)6]0.88为正极,有机固体(3,4,9,10-苝二甲酰亚胺(PTCDI))为负极,1.0 M的(NH4)2SO4水溶液为电解质。这种新型的水溶液铵离子电池表现出优异的电化学性能:平均工作电压约为1.0 V;双电极的活性物质的能量密度约为43 Wh/Kg;优异循环寿命:超过1000次循环后容量保持率为67%。在150 mA/g电流密度下(2.5 C,定义Ni-APW的电流密度60 mA/g为1C)具有相当稳定的循环性能:持续60个循环,CE稳定在约98.0%;Ni-APW电极还具有高倍率性能和出色的循环寿命。在2.5、5、10、20和30C下放电容量值分别为60、51、40、28和22 mAh/g。以5 C的中等电流密度检查了其长期循环寿命,在2000次循环之后,放电容量从51.3 mAh/g降低到37.8 mAh/g,对应于容量保持约74%,平均CE为99.4%[16]。
1.2.3 普鲁士蓝类化合物
尽管集成电网的大规模储能的容量需求快速增长,但最近的电池研究和商业开发主要集中在适用于便携式电子设备和车辆的材料系统[17],解决短期瞬变的管理和电网的相关频率调节问题的代价已经极其昂贵[18]。目前使用压缩空气和泵送水电的电网规模储能系统的能源效率低,并且仅限于特定位置[19]。虽然飞轮系统可以在高功率输入和输出下保持高效,但它们无法进行大量能源存储。现有的电池技术无法满足足够低的成本达到优异的循环寿命、高输入/输出功率和循环效率以支持电网。廉价的铅酸电池仅在有限的深度上运行放电,并且循环寿命和能源效率都很差;氧化还原液流电池和钠/氯化镍电池无法在足够高的功率水平下运行。其他替代品,例如钠/硫,镍/金属氢化物和锂离子电池提供了更好的性能,但是成本太高而不能作为与电网一起使用的主要能量存储介质[20]。
因此,新材料必须具备廉价,高效,耐用,高功率的特性。Colin等人报道了使用两种开放电极材料,六氰基铁酸铜(CuHCF)和六氰基铁酸镍(NiHCF)的结果,这两种材料都具有普鲁士蓝类化合物晶体结构,并且在水溶液电解质中,易于嵌入Li ,Na ,K 和NH4 等各种离子。CuHCF和NiHCF电极厚度约为100 μm,质量载荷为5~10 mg/cm2,与现有的锂离子电池相似。这些相对便宜的材料在安全廉价的水溶液电解质中具有可靠的电化学性能,并且可以在适度温度下使用本体方法合成。因此,它们特别适用于为电网提供存储容量。将60 mA/g定义为1C,在高电流密度下,CuHCF和NiHCF都显示出高倍率性能,保持其大部分容量。这可归因于多孔纳米颗粒电极形态、这些材料的刚性以及开放框架晶体结构。当与K 循环时,CuHCF的容量保持率最大,它在8.3 C下具有94.7%的容量保持率,在41.7 C下具有84%的容量保持率。将NH4 和Li 插入CuHCF中,在41.7 C下也保持其放电容量的75%和65%。另一方面,CuHCF在与Na 反应期间表现出差的性能,在与Na 和K 的反应过程中,NiHCF在8.3 C的电流密度下保持86%的放电容量,在41.7 C下保持66%。相比之下,发现NiHCF在Li 和NH4 循环过程中表现最差,在41.7 C电流密度下分别只有58%和39%的放电容量保持[20]。这些结果与锂离子电池电极(如LiFePO4)以及钠离子电极材料Na4Mn9O18的容量保持率相比更受青睐[21]。
1.3 表面活性剂在电池中的应用
目前电池材料向纳米级发展,因为纳米材料具有特殊的微观形貌及结构、嵌入/脱嵌容量高、能量密度高和循环寿命长等特点[22]。然而纳米颗粒团聚和大小,电极材料与电解液接触面积小,电解液的缓蚀效果等问题的解决都需要用到表面活性剂[23]。
1.3.1 表面活性剂在制备电池材料中的应用
用SDBS为模版制得的MnO2对电池循环性能有阻碍作用,CTAB稍微欸提高了电池的循环性能,TritonX-100提高了电池的放电容量和循环性能[24]。而用Brij56作为电解液,用电沉淀法制得纳米级MnO2正极材料表现出很好的循环性能和很高的放电容量[23]。
表面活性剂不仅可以控制颗粒大小,使晶体排列有序,还可以控制孔隙度,提高所制电极的电性能[23]。在含P123的乙醇溶液中制得的纳米SnO2/C复合材料和纳米锡基氧化物/碳复合材料,将其作为锂离子电池负极和一般纳米锡基材料相比,显示出更加优良的循环性能[23]。
1.3.2 表面活性剂对电解液的影响
许多研究致力于调整水的电化学稳定窗口,如调节PH值是控制水溶液电解质分解的常用做法[25,26]。Xia等通过将电解液的PH调节到13,将氢析出的电位从-0.43 V变为-0.8 V以抑制氢的释放[27]。加宽水溶液电解质的电化学稳定窗口的另一种方法就是提高水溶液中盐的浓度[28,29]。最近Wang等利用一种新的“盐水”电解质,其电化学稳定窗口扩展到了约3.0 V[30,31]。
另外,Hou等发现在电解质中加入十二烷基硫酸钠(SDS)可以有效抑制电极表面氢的释放,因此电池表现出高的库仑效率和优异的循环稳定性[32]。通过向电解质中加入SDS以抑制氢或氧的释放,扩大了水溶液电解质电化学稳定窗口。当SDS加入到电解质中时,SDS分子将通过静电吸附吸附在电极表面上,吸附的SDS分子可以有效地防止电极和水之间的接触,水分子难以通过疏水层。此外,SDS表面活性剂在这种溶液中可以抑制锌的腐蚀,以Na2MnFe(CN)6阴极和锌阳极组成的水溶液可充电电池的容量为137 mAh/g,工作电压高达2.0 V,相当于170 Wh/kg的高能量密度。此外,它还在低电流密度下(0.5 C)表现出优异的循环稳定性和高库仑效率(超过97%)。同时在充电过程中抑制锌的树枝状微晶的形成,从而避免严重的短路问题。此外,锰的溶解受到抑制,Na2MnFe(CN)6的结构在2000次循环后保持稳定。因此,组装后的全电池显示出良好的循环能力和高库仑效率。
1.4 本论文的研究内容和意义
之前报道的铵根离子电池选用普鲁士白类似物(NH4)1.47Ni[Fe(CN)6]0.88作正极,其在倍率性能测试时,在150 mA/g电流密度下,放电容量为60 mAh/g,而在1800 mA/g电流密度下,放电容量仅为22 mAh/g,可见其倍率性能一般。本实验试图寻找一种更好的普鲁士蓝类化合物作为铵根离子电池的正极,希望提高其倍率性能。作为水溶液可充电电池的通病,水的电化学稳定窗口较窄,且容易发生析氢反应,我们借鉴Hou等人的方法,向电解液中加入表面活性剂以解决这些问题。本文将研究介绍阴离子型表面活性剂SDS和非离子型表面活性剂PEG-400分别对电极材料在水溶液中电化学性能的影响,不同类型的表面活性剂在电解液中有不同的作用。
第二章 实验部分
2.1 实验试剂
本实验所用的试剂见表2-1。
表2-1 实验试剂
试剂/材料 | 生产单位 | 备注 |
六水合硝酸镍 | 阿拉丁试剂(上海)有限公司 | / |
铁氰化钾 | 阿拉丁试剂(上海)有限公司 | / |
乙炔黑 | 国药集团化学试剂有限公司 | 粒径:约15 nm |
硫酸铵 | 阿拉丁试剂(上海)有限公司 | / |
聚四氟乙烯(PTFE) | 上海麦克林生化科技有限公司 | 60wt%分散液 |
十二烷基硫酸钠(SDS) | 阿拉丁试剂(上海)有限公司 | ≥99.0% |
聚乙二醇(PEG-400) | 国药集团化学试剂有限公司 | / |
无水乙醇 | 国药集团化学试剂有限公司 | A.R |
2.2 实验仪器
本实验所用实验仪器见表2-2。
表2-2 实验仪器
名称 | 生产厂家 | 规格 |
恒温磁力搅拌仪 | 上海司乐仪器厂 | 81-2 |
恒温干燥箱 | 上海森信实验仪器有限公司 | DGG-9053A |
真空干燥箱 | 上海森信实验仪器有限公司 | DZG-6050 |
电子天平 | 上海恒平科学仪器有限公司 | FA2004 |
扫描电子显微镜(SEM) | Philips | XL-70 |
续表2-2
名称 | 生产厂家 | 规格 |
离子溅射仪 | 北京中科科仪股份有限公司 | SBC-12 |
X射线衍射仪(XRD) | Rigaku Corporation | SmartLab3KM |
TG/DTA综合热分析仪 | Perkin Elmer | TGA7/DTA7 |
傅里叶红外光谱仪 | Bruker | ALPHA |
超声波清洗器 | 昆山市超声仪器有限公司 | KQ-100DE |
高速离心机 | 上海安亭科学仪器厂 | TGL-10B |
Land电池测试系统 | 武汉力兴电源有限公司 | CT2001A |
电化学工作站 | 上海辰华仪器有限公司 | CHI660E |
2.3 铵根离子电池正极的制备
2.3.1活性物质NiHCF的合成
使用共沉淀法合成活性物质NiHCF。首先,将0.5268 g的K3Fe(CN)6溶解在40 mL超纯水中,加以搅拌20分钟使其溶解完全;同时将0.93 g的Ni(NO3)2·6H2O溶解在80 mL超纯水中,加以搅拌20分钟使其溶解完全。然后,在磁力搅拌仪下,通过分液漏斗将K3Fe(CN)6溶液逐滴滴加到Ni(NO3)2·6H2O溶液中。在搅拌20分钟后,将反应好的悬浮液在70℃的油浴中加热20小时。待加热结束后,将悬浮液离心分离,用水和乙醇各洗涤3次。然后将产物放入真空干燥箱中80 ℃干燥24小时,之后将最终产物密封避光贮存。
2.3.2 铵根离子电池正极极片的制作
取10mL烧杯,称取3~4滴聚四氟乙烯(PTFE),加入约5 mL无水乙醇后,将烧杯放入超声波清洗机中超声分散。按NiHCF活性材料:乙炔黑:聚四氟乙烯(PTFE)以7:2:1的质量比,称取适量的NiHCF和乙炔黑混合研磨。混合均匀后倒入超声中的PTFE溶液,超声分散5分钟左右取出。在红外灯下将混合溶液烘干,制成极片,放入恒温干燥箱中60 ℃干燥20小时后取出,密封避光贮存。
2.4 活性物质NiHCF的物理表征
2.4.1 形貌表征
实验室的扫描电子显微镜SEM最小可观测约2 μm的形貌,其成像能力要弱于场发射电子显微镜。因为NiHCF具有磁性,所以在拍摄电镜前要对样品进行喷金处理。本实验采用Philips XL-70型扫描电子显微镜,制样过程为:将干燥的活性物质NiHCF直接粘于样品台上,对其进行喷金处理后观察其形貌[33]。样品喷金处理使用的是SBC-12型离子溅射仪,喷金时间为100 s。
2.4.2 热稳定性表征
本实验热稳定性表征采用了热重分析。在可控的速率下,测量样品质量变化量关于时间和温度的函数,根据材料质量随温度的变化表征其热稳定性[34]。此外,TG还可以根据蒸发或分解温度分析原材料的组分。本实验使用的分析仪为Perkin Elmer TGA7/DTA7型综合热分析仪。进行TG分析时在N2气氛下进行,升温速率10 ℃/ min, 温度范围20~600 ℃。
2.4.3 X射线衍射表征
对制备好的NiHCF进行X射线衍射表征,将得到的衍射峰与已知的Fm-3m空间群的衍射峰进行比对,来确定活性物质NiHCF是否具有普鲁士蓝类化合物的晶体结构。我们测试的扫描范围为10° ~ 90°,扫描速度为10°/min。
2.4.4 傅里叶转换红外线光谱测试
首先收集背景的干涉图及样品的干涉图[35],最终得到样品的透射光谱或吸收光谱。我们用FTIR技术来确定制备的NiHCF中的成分,确定NiHCF的晶体结构能够满足NH4 离子的嵌入。
2.5 电化学性能测试
本实验希望通过对比实验得出表面活性剂对电极材料在水溶液中稳定性的影响。在下面实验中,我们试图在相同或相似条件下对三种电池体系进行同样的电化学性能测试。
2.5.1 未添加表面活性剂
从上述步骤得到的极片上截取1 mg左右的电极极片附着在石墨棒上,将(NH4)2SO4溶于蒸馏水中制成浓度为1 mol/L电解液,石墨电极和甘汞电极分别用作对电极和参比电极,在CHI660E电化学工作站(上海)对该电池体系进行循环伏安测试,得到NiHCF正极在3 mV/s、5 mV/s、7 mV/s、10 mV/s扫描速度,0~1 V扫描范围下的循环伏安图。同时在工作站上对该电池体系循环前后进行阻抗测试。
本文采用了Land CT2001A型充放电测试仪,测试电池为半电池体系。在恒温26 ℃,在1 A/g的电流密度下,测得电池的充放电容量。分别在恒温26 ℃下,在2.5、5、7.5、10、15、20和40 C(1 C=60 mA/g)电流密度下,对该体系进行倍率性能测试。根据正极活性物质的质量,恒温26 ℃时对该体系进行3000次循环测试(电流密度为1 A/g)。
2.5.2 添加SDS表面活性剂
用小烧杯取50 mL的1 mol/L的硫酸铵溶液,用滴管滴加2~3滴0.1 mol/L的SDS溶液混合,该溶液用作电解液,进行与2.5.1所采取的电化学测量步骤相似的步骤。但由于SDS的加入,使得极片与集流体不能紧密贴合,影响测试。从而选取新的集流体:石墨毡。用铂电极夹夹持石墨毡,防止电化学工作站的铁夹被腐蚀。根据Colin的科学研究,SDS的加入会一定程度上抑制水的析氢反应,从而扩大水的电化学稳定窗口,实验将循环伏安测试设置的扫描范围扩展到-0.2 V~1.2 V。可能是由于SDS的引入引发了电池中的副反应,致使在低电流密度下,该电池体系无法进行循环测试和倍率测试,于是我们将倍率测试的起始电流密度设为7.5 C(1 C=60 mA/g),同样在电流密度1 A/g下进行循环性能测试。
2.5.3 添加PEG-400表面活性剂
本实验我们所测试内容与上两个体系的内容相似。在进行循环伏安法测试时,我们经过多次扫描范围的尝试后发现,加入PEG-400并不会扩大电化学稳定窗口,所以循环伏安法的扫描范围依旧为0~1 V。依旧采用石磨棒作为集流体,在电流密度1 A/g下进行循环性能测试。在恒温26℃,分别在5、7.5、10、15、20、40 C(1 C=60 mA/g)的电流密度下,对该体系进行倍率性能测试。
第三章 结果与讨论
3.1 NiHCF的制备方法
本实验采取了控制变量法,制备了多批次不同条件下合成的NiHCF,对活性物质进行简单的电化学测试。通过对比得到,在合成过程中恒温70 ℃得到的材料的结晶度最好,电化学性能最好。并且在恒温70 ℃静置的过程中不能搅拌,否则将会破坏NiHCF的晶体结构。由于制备得到NiHCF嵌入NH4 不如嵌入Na 、K 稳定,所以对材料要求较为严格,制备好的NiHCF需要密封避光贮存,且一般只能保持1个月的活性。
3.2 NiHCF的物理表征结果
用X射线衍射(XRD)对合成的NiHCF材料的晶体结构进行确认。从图3-1a可以看出所有的XRD衍射峰都可以与Fm-3m空间群很好地匹配,表明此活性物质NiHCF具有普鲁士蓝类化合物的晶体结构。
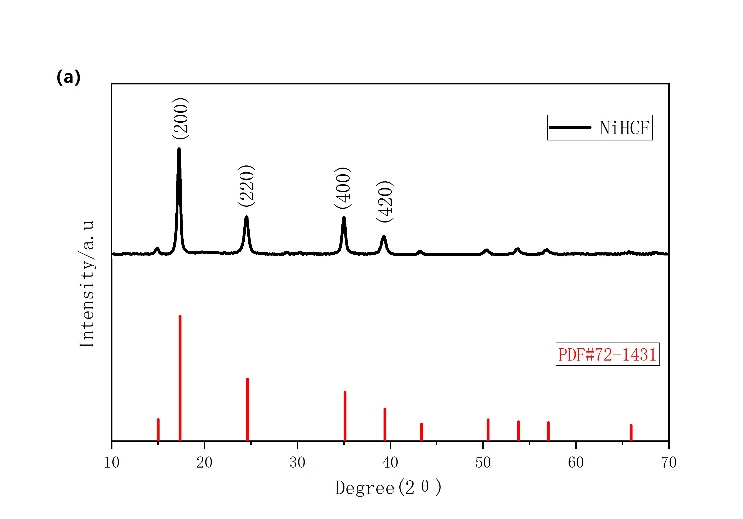

图3-1 (a)NiHCF的XRD图谱(对比PDF#72-1431);(b)NiHCF的扫描电子显微镜图像
通过拍摄所得的SEM图片(图3-1b)可以得知,使用本实验所采用的合成方法能够形成高度结晶的纳米颗粒NiHCF,所得的NiHCF纳米颗粒的多孔聚集体因为其高表面积与体积比,允许电荷载体在包含NiHCF的电极中快速传输。
热重是分析材料中水含量的常规检测方法之一,通过图3-2我们可知,NiHCF的失重过程大致为三个阶段。第一阶段是在150 ℃左右,失去了约27%的重量,这是结合力较弱的水,多为材料表面和间隙中的吸附水;第二阶段是在270 ℃左右,失去了约6%的重量,这是由于晶格水的脱出;第三阶段是在450 ℃左右,这是因为NiHCF的分解和C≡N键的释放。
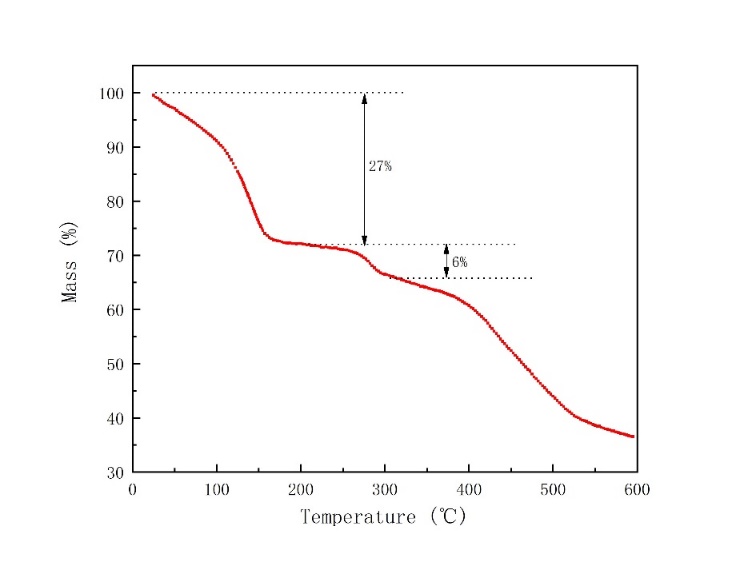
图3-2 NiHCF材料的热重曲线图
NiHCF的傅里叶红外光谱(图3-3)分别在3625和1610 cm-1处出现两个峰,对应于H2O中的O-H的伸缩振动和弯曲振动,在2166 cm-1处出现一个峰,对应于C≡N的伸缩振动[36]。
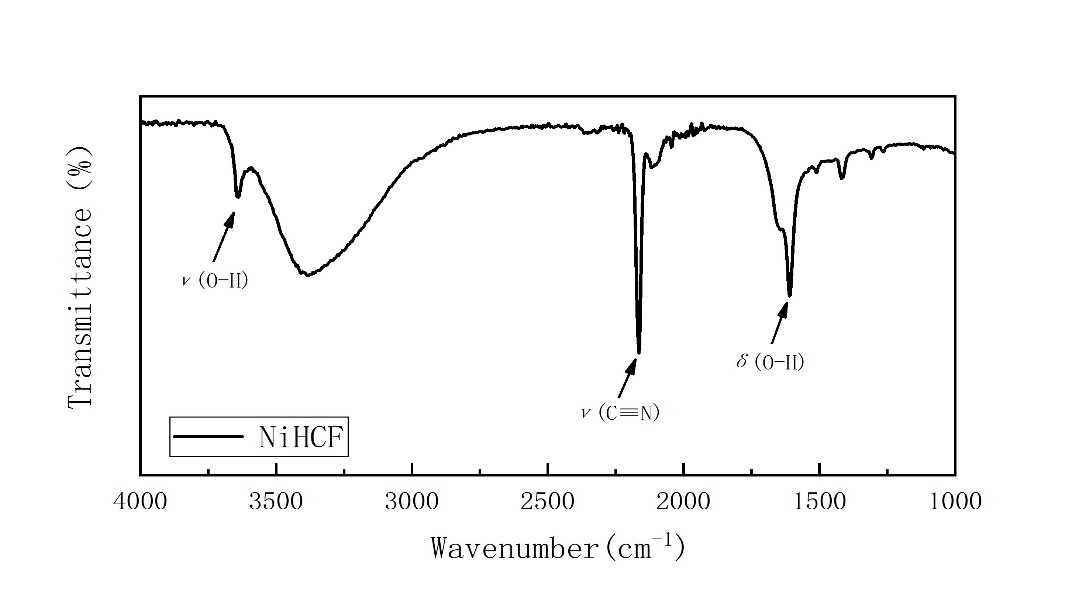
图3-3 NiHCF材料的傅里叶红外光谱图
3.3 NiHCF的电化学性能
为了研究NiHCF在未加表面活性剂SDS的铵根离子电池中的电化学行为,进行了阻抗测试、循环伏安测试、倍率性能和恒电流循环性能测试。对NiHCF在0~1 V电位范围内进行了循环伏安扫描,扫描速度分别为3 mV/s、5 mV/s、7 mV/s、10 mV/s。由循环伏安图(图3-4a)可读出在3 mV/s、5 mV/s、7 mV/s、10 mV/s扫描速度下的阳极峰电位分别为0.543 V、0.572 V、0.605 V、0.642 V;阴极峰电位分别为0.376 V、0.352 V、0.333 V、0.308 V。通过蓝电系统测试得到未添加表面活性剂的铵根离子电池在1 A/g电流密度下的比容量约为45 mAh/g,虽然其与常见锂离子电池的LiCoO2和LiFePO4电极的130 mAh/g和170 mAh/g的比容量相比较差,但是他们的合成成本低,速率高,循环寿命长和安全性使他们特别适合用于大规模固定应用。我们将60 mA/g定义为1 C,因此1 A/g相当于16.67 C。通过对NiHCF电极的充放电曲线(电流密度为16.67 C)分析可知(图3-4b),有一个0.55 V的充电平台和一个0.46 V的放电平台。
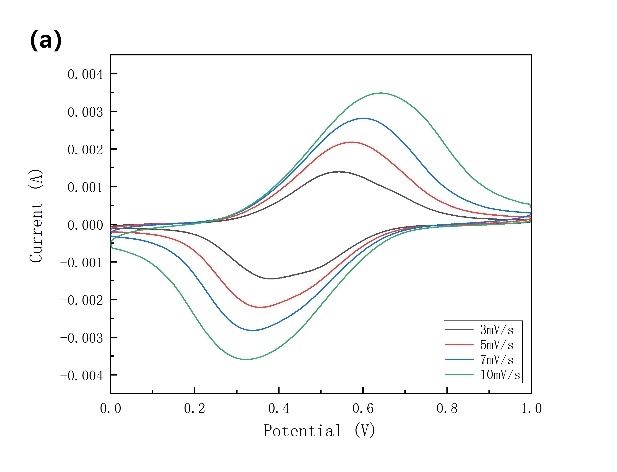
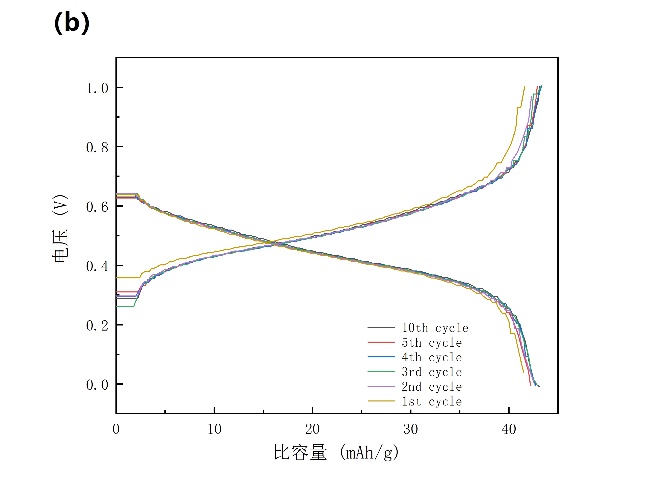
图3-4 (a)NiHCF的循环伏安图,扫描速度分别为3 mV/s、5 mV/s、7 mV/s、10 mV/s,使用石墨作为对电极和Hg/Hg2Cl2作为参比电极;(b)NiHCF正极在电解液中的充放电曲线,电流密度为16.67 C。
通过对NiHCF极片的FTIR分析,验证了活性物质NiHCF中NH4 离子的嵌入是成功且稳定的。在3250和1375 cm-1处可观察到两个新的峰(图3-5a),这与N-H键的伸缩振动和变形振动有关。N-H信号的出现证明了NH4 离子成功地嵌入到NiHCF纳米粒子的晶格中。为了了解NiHCF在NH4 离子嵌入/脱嵌过程中的结构变化,记录了不同充放电电位下的非原位XRD图谱(图3-5b)。在所有选择的电位下的非原位XRD图谱上都可以找到一致的FCC结构,表明NH4离子的嵌入/脱嵌是固溶体反应。
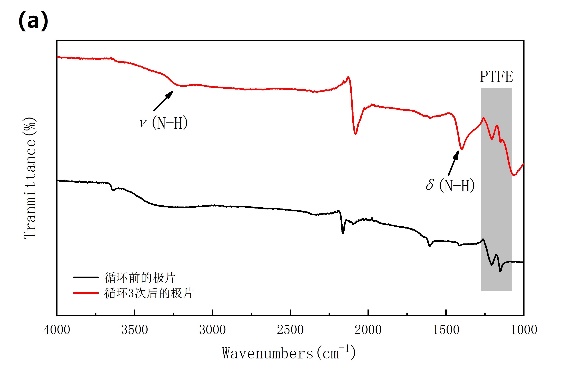
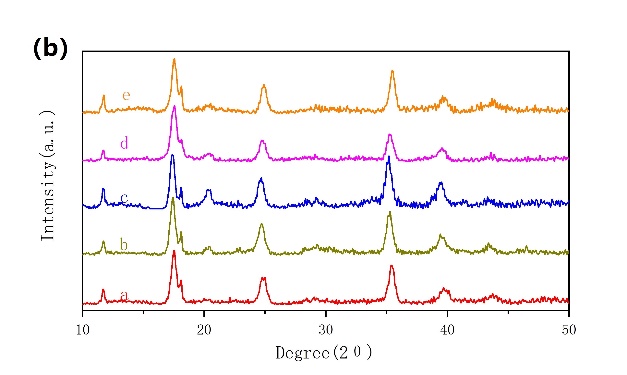
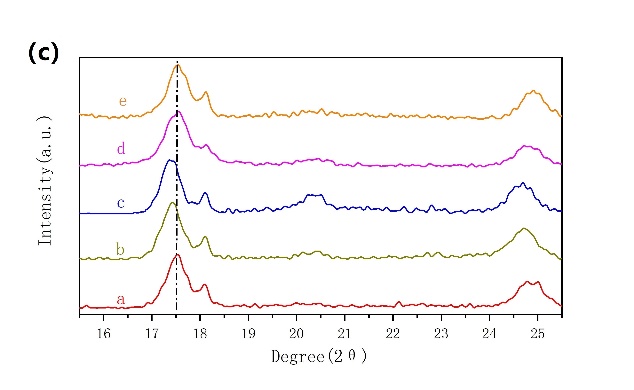
图3-5 (a)循环前后NiHCF极片的FTIR对比;(b、c)非原位XRD图谱。a是起始电位,b为充电至0.55 V,c为充电至1 V,d为放电至0.46 V,e为放电至0 V。
为了测试NiHCF在铵根离子电池中的循环性能,我们用石墨电极和Hg/Hg2Cl2电极分别作对电极和参比电极装成半电池,在1 A/g的速率下进行5000次的恒电流循环测试(图3-6a)。在1000次、2000次、3000次和5000次循环后保持其初始容量的88.8%、75.9%、65.5%和 59.1%。在循环过程中,NiHCF电极材料还保持接近99%的库仑效率。实验过程中,我们能看到三电解槽内NiHCF电极表面有气泡产生,三电解槽中的电解液也呈现微黄色,这说明NiHCF在电化学测试中会溶解在电解液中,影响电池的高速率循环寿命。对电池的倍率性能也进行了研究,如图3-6b所示。在2.5、5、7.5、10、15、20和40 C的电流密度下放电容量值分别为57、50、48、45、40、37和33 mAh/g。目前我们所采用的NiHCF作正极材料,其倍率性能已经比Wu报道的要优异许多,但循环稳定性并没有显著提升。
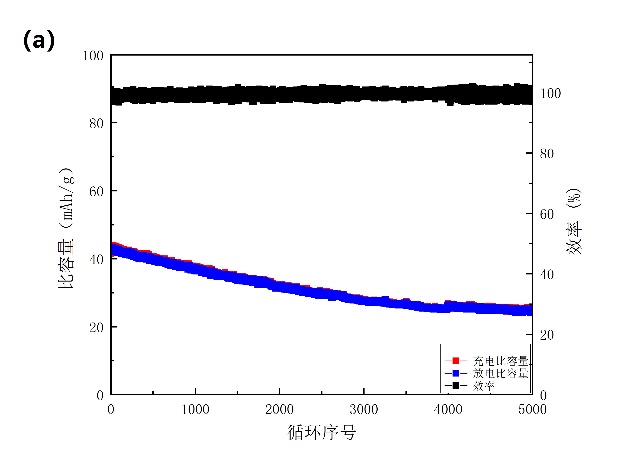
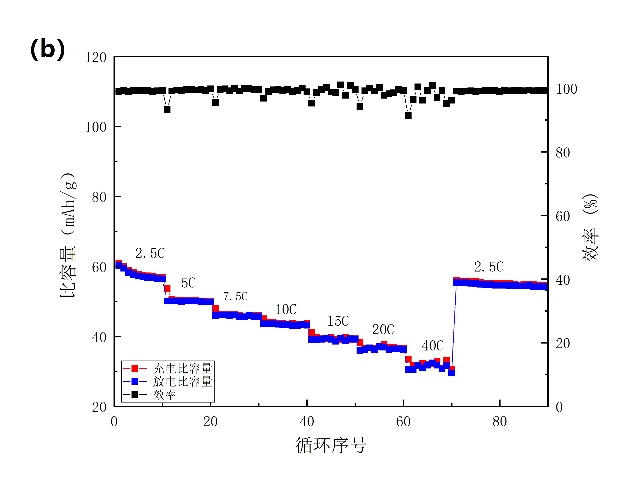
图3-6 (a)以16.67 C的速率进行循环测试;(b)倍率性能。1 C=60 mA/g。
3.4 加入SDS后的电化学性能
如3-7a所示,在不同扫速下得到的电解液中添加SDS的CV图中只含有一对氧化还原峰,这说明该电池只存在一对充放电平台。但是在低电流密度下我们在2.5 C的电流密度和-0.2 V~0.9 V电压区间下进行充放电测试,我们发现在接近充电结束和放电结束的电压附近出现了类似充放电平台(图3-7b),这与CV图中的阴极/阳极峰不符,我们认为与电池的集流体和电池难以低电流密度循环有关。
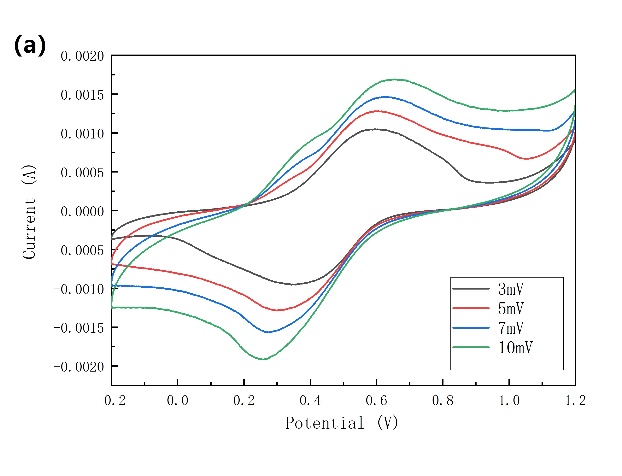
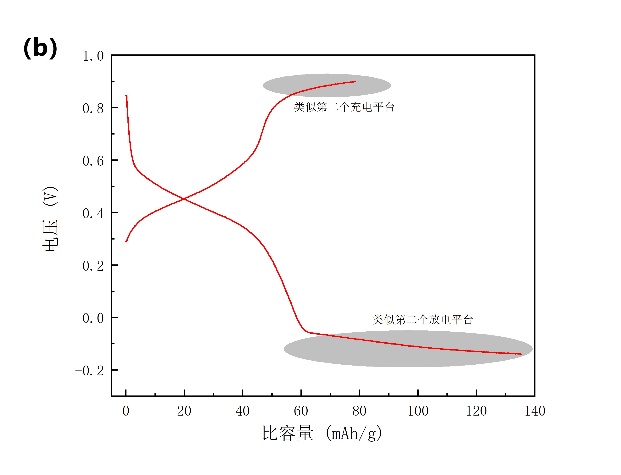
图3-7 (a)电解质中加入SDS的NiHCF的CV曲线;(b)以石磨棒为集流体,电解液中加入SDS的NiHCF在2.5 C下的充放电曲线,其中1 C=60 mA/g。
于是在循环性能测试和倍率性能测试时,我们选用了石墨毡作为集流体,重新进行测试。测试结果如图3-8,CV图中显示出的一对阴极/阳极峰与充放电曲线中显示的约0.5 V的充电平台和约0.4 V的放电平台相一致
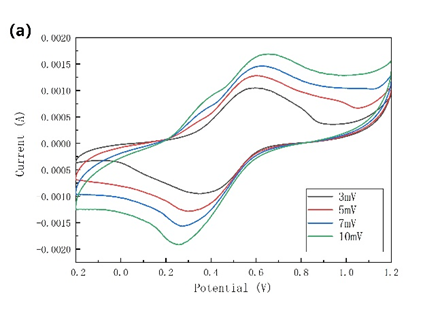
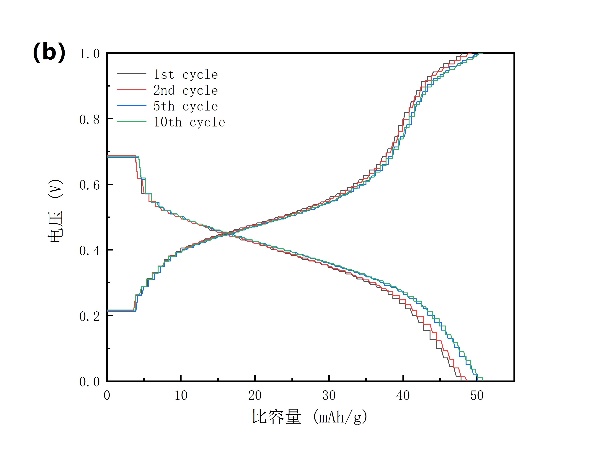
图3-8 (a)电解质中加入SDS的NiHCF的CV曲线;(b)以石墨毡为集流体,电解液中加入SDS的NiHCF在2.5 C下的充放电曲线,其中1 C=60 mA/g。
在1 A/g的速率下进行3000次的恒电流循环测试(图3-9a)。在1000次、2000次和3000次循环后分别保持其初始容量的87.6%、84.09%和80.33%;NiHCF还保持接近98%的库仑效率。在三电解槽中,我们能看到NiHCF电极材料表面未产生气泡,三电解槽中的电解液也未变色,这说明添加SDS后NiHCF在电化学测试中没有溶解,且抑制了水的析氢反应,提高电池的高速率循环寿命。对电池的倍率性能也进行了研究,如图3-9b所示,在7.5、10、15、20和40 C的电流密度下放电容量值分别为55、46、40、37和32 mAh/g。
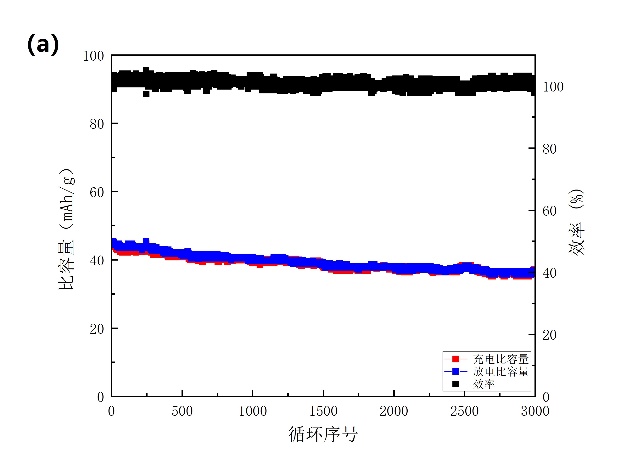
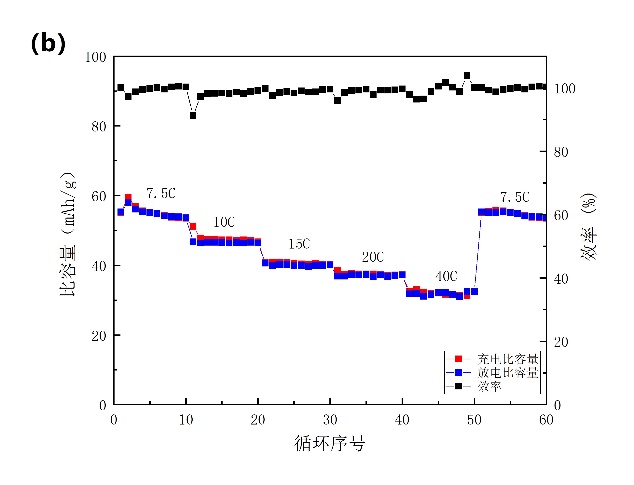
图3-9 添加SDS后的测试。(a)以16.67 C的速率进行循环测试;(b)倍率性能。
通过对比3000次循环后的容量保持率(图3-10a),我们可以直观发现SDS的添加确实很大程度上提高了电池的循环寿命。结合循环过程中电解槽的实验现象可知,表面活性剂SDS的引入在一定程度上抑制了活性物质NiHCF的分解,并且抑制了水的析氢,提高了该电池的循环稳定性。
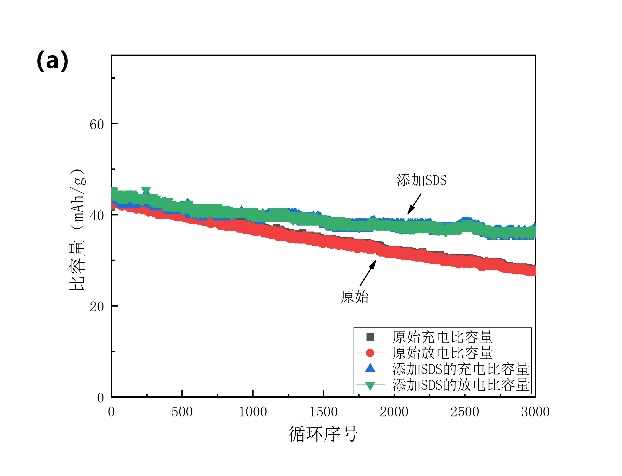
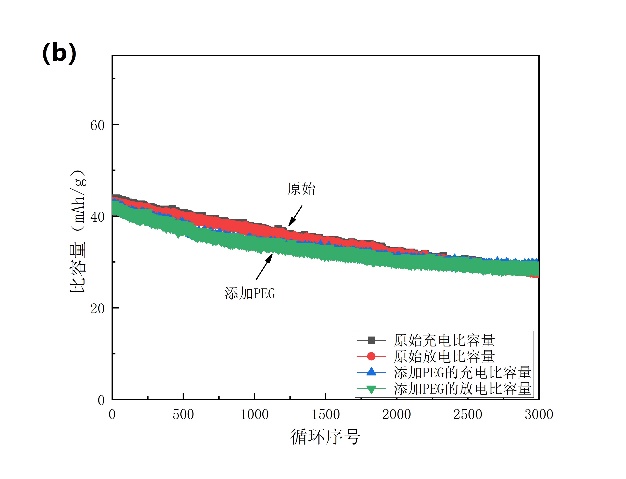
图3-10(a)添加SDS的电池与原始电池的对比;(b)添加PEG的电池与原始电池的对比。
3.5 加入PEG-400后的电化学性能
NiHCF正极材料在添加PEG-400的电解液中的CV结果清晰的表明,在0.55 V左右存在唯一一个阴极峰(图3-11a)。还测试了其在1 A/g的电流密度下、电压区间为0~1 V的充放电性能,充放电曲线(图3-11b)中可以明显看到0.6 V的充电平台和0.42 V的放电平台,这与CV的结果一致。
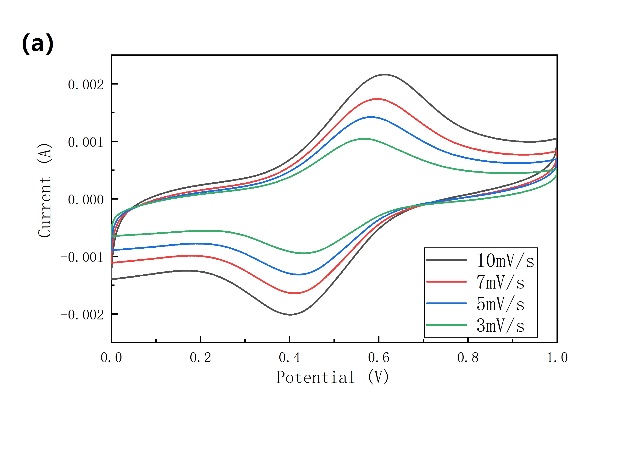
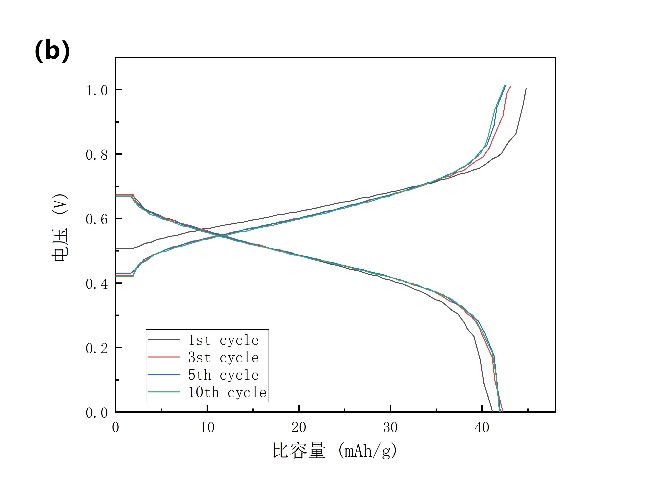
图3-11 (a)NiHCF在添加PEG电解液中的循环伏安图;(b)NiHCF正极在添加PEG电解液中的充放电曲线,速率为16.67 C。
在1A/g的电流密度下进行3000次的恒温恒电流循环测试(图3-12a)。在1000次、2000次、3000次循环后分别保持其初始容量的82.37%、73.9%、69.32%。NiHCF还保持接近98%的库仑效率。对电池的倍率性能也进行了研究,结果如图3-12b所示,在5、7.5、10、15、20和40 C的电流密度下放电容量值分别为50、43、41、37、34.8和32 mAh/g。
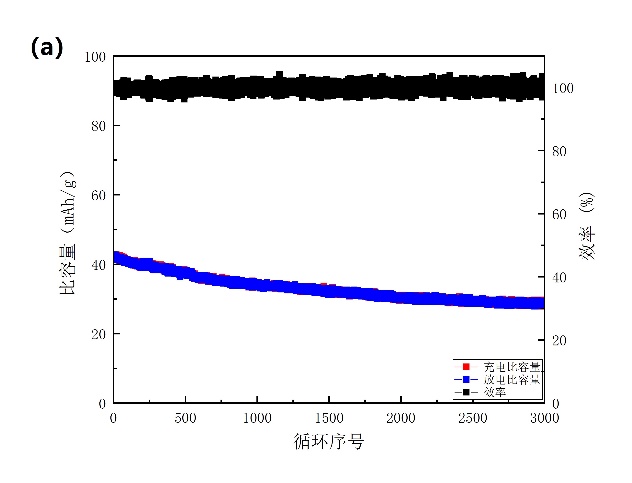
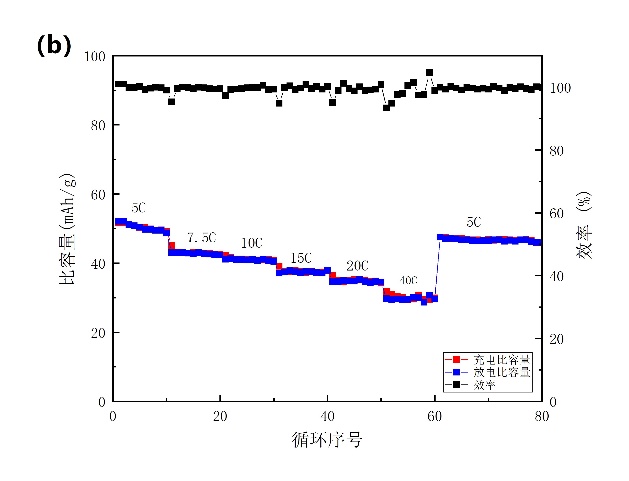
图3-12 添加PEG后的测试。(a)以16.67 C的速率进行循环测试;(b)倍率性能。
通过对比3000次循环后的容量保持率(图3-10b),可以发现加入PEG-400后并未提高电池的循环寿命,还略降低了稳定性,这可能与PEG属于非离子型表面活性剂有关。
3.6 各电池体系的阻抗分析
对各种电解液组成的电池体系,分别在其循环前后进行阻抗测试。从各种电池循环前后的对比图(图3-12)可知,电解液中加入SDS之后,欧姆阻抗较原始电解液略低;电解液中加入PEG-400的欧姆阻抗与原始电解液相比较高,该结果与三种电解液的电池的循环性能的对比是吻合的。
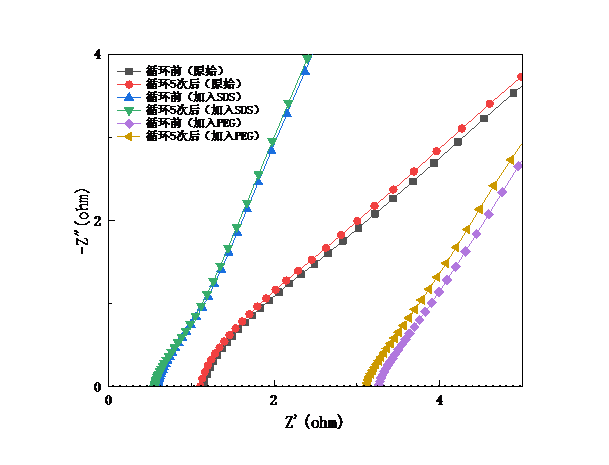
图3-13 不同电池体系在循环前后的阻抗对比图
第四章 结论与展望
4.1 结论
本实验铵根离子电池采用的正极材料NiHCF在原始电解液中表现出来的循环性能和倍率性能,与Wu报道的铵根离子电池的循环性能和倍率性能相比表现出相当甚至更好的性能。本实验已经证明,通过向电解液中加入SDS表面活性剂,使得SDS分子可以通过静电吸附吸附在电极表面上。吸附地SDS分子可以有效地防止电极和水之间的接触,水分子也难以通过疏水层,因此有效地抑制氢的释放。此外,SDS表面活性剂可以抑制NiHCF的分解,在长循环之后保持结构的稳定,因此电池表现出良好的循环稳定性和高库仑效率。
4.2 展望
铵根离子电池的研究目前还处于探索阶段,正极材料的选择需要不断地尝试得到更好的活性物质。但是由于时间原因,课题中明显还存在有几个问题需要继续研究:(1)是否表面活性剂加入的量对电化学性能有影响;(2)为什么加入SDS后,石磨棒不再适合作为正极的集流体;(3)SDS表面活性剂表现出的性能能否在其他铵盐电解液中展现。
为了解决大规模储能的容量需求,科学家们将目光移至水溶液电池,但是铵根离子电池的比容量还是较低,离实际应用还有很长的路要走,希望该课题所研究的方向能够适用于探索更高能量密度和更高循环稳定性的研究之中。
参考文献
[1] 张涵奇, 孙德强, 郑军卫, et al. 世界工业革命与能源革命更替规律及对我国能源发展的启示[J]. 中国能源, 2015, 37(7): 35-37.
[2] 李青. 三维花状金属氧化物纳米材料的合成及其电化学性能研究[D]. 湖南大学, 2014.
[3] 曹翊, 王永刚, 王青, et al. 水系钠离子电池的现状及展望[J]. 储能科学与技术, 2016, 5(3): 317-324.
[4] Liu S, Shao L, Zhang X, et al. Advances in Electrode Materials for Aqueous Rechargeable Sodium-Ion Batteries[J]. Acta Physico-Chimica Sinica, 2018, 34(6): 581-597.
[5] Tafur J P, Abad J, Román E, et al. Charge storage mechanism of MnO2 cathodes in Zn/MnO2 batteries using ionic liquid-based gel polymer electrolytes[J]. Electrochemistry Communications, 2015, 60: 190-194.
[6] Junshan L, Qiang F. Development of Zinc Electrodes for Secondary Akaline Batteries [J][J]. Marine Electric amp; Electronic Engineering, 2010, 7.
[7] Laska C A, Auinger M, Biedermann P U, et al. Effect of hydrogen carbonate and chloride on zinc corrosion investigated by a scanning flow cell system[J]. Electrochimica Acta, 2015, 159: 198-209.
[8] Li Q, Bjerrum N J. Aluminum as anode for energy storage and conversion: a review[J]. Journal of Power Sources, 2002, 110(1): 1-10.
[9] Doche M, Novel-Cattin F, Durand R, et al. Characterization of different grades of aluminum anodes for aluminum/air batteries[J]. Journal of Power Sources, 1997, 65(1-2): 197-205.
[10] Linden D, Reddy T B. Handbook of batteries[M]. McGraw-Hill Professional, 2002.
[11] Jayaprakash N, Das S K, Archer L A. The rechargeable aluminum-ion battery[J]. Chem Commun (Camb), 2011, 47(47): 12610-2.
[12] Reed L, Ortiz S, Xiong M, et al. A rechargeable aluminum-ion battery utilizing a copper hexacyanoferrate cathode in an organic electrolyte[J]. Chemical Communications, 2015, 51(76): 14397-14400.
[13] Reed L D, Arteaga A, Menke E J. A Combined Experimental and Computational Study of an Aluminum Triflate/Diglyme Electrolyte[J]. The Journal of Physical Chemistry B, 2015, 119(39): 12677-12681.
[14] Gu S, Wang H, Wu C, et al. Confirming reversible Al3 storage mechanism through intercalation of Al3 into V2O5 nanowires in a rechargeable aluminum battery[J]. Energy Storage Materials, 2017, 6: 9-17.
[15] Wang H, Bai Y, Chen S, et al. O 5 cathode for greener rechargeable aluminum battery[J]. ACS Appl. Mater. Interfaces, 2015, 7: 80-84.
[16] Wu X, Qi Y, Hong J J, et al. Rocking-Chair Ammonium-Ion Battery: A Highly Reversible Aqueous Energy Storage System[J]. Angew Chem Int Ed Engl, 2017, 56(42): 13026-13030.
[17] Yang Z, Zhang J, Kintner-Meyer M C, et al. Electrochemical energy storage for green grid[J]. Chemical reviews, 2011, 111(5): 3577-3613.
[18] Lacommare K H, Eto J H. Understanding the cost of power interruptions to US electricity consumers[R]. Lawrence Berkeley National Lab.(LBNL), Berkeley, CA (United States), 2004.
[19] Barton J P, Infield D G. Energy storage and its use with intermittent renewable energy[J]. IEEE transactions on energy conversion, 2004, 19(2): 441-448.
[20] Wessells C D, Peddada S V, Mcdowell M T, et al. The Effect of Insertion Species on Nanostructured Open Framework Hexacyanoferrate Battery Electrodes[J]. Journal of The Electrochemical Society, 2011, 159(2): A98-A103.
[21] Whitacre J, Tevar A, Sharma S. Na4Mn9O18 as a positive electrode material for an aqueous electrolyte sodium-ion energy storage device[J]. Electrochemistry Communications, 2010, 12(3): 463-466.
[22] 尤金跨, 杨勇, 舒东, et al. 锂离子电池纳米电极材料研究 ①[J]. 电化学, 1998, 4(1).
[23] 宋金梅, 张玉秀, 朱书全, et al. 表面活性剂在电池材料中的应用[D]. 2011.
[24] Ghaemi M, Khosravi-Fard L, Neshati J. Improved performance of rechargeable alkaline batteries via surfactant-mediated electrosynthesis of MnO2[J]. Journal of power sources, 2005, 141(2): 340-350.
[25] Chen L, Guo Z, Xia Y, et al. High-voltage aqueous battery approaching 3 V using an acidic–alkaline double electrolyte[J]. Chemical Communications, 2013, 49(22): 2204-2206.
[26] Chen L, Dong X, Wang F, et al. Base–acid hybrid water electrolysis[J]. Chemical Communications, 2016, 52(15): 3147-3150.
[27] Luo J-Y, Cui W-J, He P, et al. Raising the cycling stability of aqueous lithium-ion batteries by eliminating oxygen in the electrolyte[J]. Nature chemistry, 2010, 2(9): 760.
[28] Ramanujapuram A, Gordon D, Magasinski A, et al. Degradation and stabilization of lithium cobalt oxide in aqueous electrolytes[J]. Energy amp; Environmental Science, 2016, 9(5): 1841-1848.
以上是毕业论文大纲或资料介绍,该课题完整毕业论文、开题报告、任务书、程序设计、图纸设计等资料请添加微信获取,微信号:bysjorg。
相关图片展示:
您可能感兴趣的文章
- 激光作用下ZrNiSn合金热电材料组成、结构和性能的演化规律开题报告
- 原位生长于碳纤维表面的钒氧化物柔性电极制备开题报告
- 锂硫电池用TixOy-S/HGs复合材料的制备与性能开题报告
- MnO2纳米片修饰ZnO纳米棒阵列的气敏性能研究开题报告
- 基于三维碳基孔结构和电解质协同优化的微型超级电容器文献综述
- 基于C-MEMS工艺的微型混合锂离子电容器构筑及性能开题报告
- 多孔碳负载钼基纳米材料作为高性能析氢电催化剂文献综述
- Cu掺杂ZnxCd1-xS纳米晶的制备与性能研究开题报告
- 用于光伏的III-V族半导体低成本生长外文翻译资料
- 太阳能电池中的GaSb / InGaAs 量子点阱混合结构有源区外文翻译资料




