Co3O4表面氧还原催化机理的第一性原理研究毕业论文
2020-02-13 14:41:38
摘 要
开发和利用清洁能源是解决日益增长的污染和能源短缺问题的重要手段。基于高效的化学-电气转换技术实现能源转换成为目前热门的研究课题。燃料电池因其具有高能量转换效率、室温快速启动以及环境友好性等特点,受到全世界研究人员广泛的关注。燃料电池主要依靠氧的氧化和还原反应进行能量转换。其中,氧还原反应(ORR)是燃料电池装置的重要部分,但是缺乏足够好的ORR催化剂严重限制了设备的整体转换效率。因此,开发和优化新型燃料电池催化剂是进一步提高燃料电池能量转换效率的关键所在。
本文采用第一性原理方法研究了Co3O4表面氧还原反应的晶面效应和催化机理。具体结果如下:
(1) 研究了Co3O4(1 1 0)和(1 1 1)表面的催化性能。(1 1 0)和(1 1 1)表面分别有两种类型,分别命名为type A和type B。其中,Co3O4(1 1 0)type B和(1 1 1)type B表面有ORR催化活性。(1 1 0)type B表面有两个活性位点,(1 1 1)type B只有一个活性位点。
(2) 根据ORR的自由能图可得,(1 1 0)type B的催化性能比(1 1 1)type B更好。
(3) 利用过渡态搜索研究了(1 1 0)type B表面的ORR反应路径,并找到了该表面上最佳的ORR反应路径。
关键字: 氧还原反应,过渡金属氧化物,密度泛函理论
Abstract
The development and utilization of clean energy is an important means of addressing the growing problem of pollution and energy shortages. Energy conversion based on efficient chemical-electrical conversion technology has become a popular research topic. Fuel cell has attracted worldwide attention due to its high energy conversion efficiency, rapid start-up at room temperature and environmental friendliness. Fuel cells rely mainly on the oxidation and reduction of oxygen for energy conversion. Among them, oxygen reduction reaction (ORR) is an important part of the fuel cell device. However, the lack of an efficient ORR catalyst severely limits the overall conversion efficiency of the device. Therefore, the development and optimization of new fuel cell catalysts is the key to further improve the energy conversion efficiency of fuel cells.
In this paper, the crystal surface effect on catalytic activities and catalytic mechanism of the oxygen reduction reaction of Co3O4 have been systematically studied by first-principles method. The results are as follows:
(1) The catalytic properties of Co3O4(1 1 0) and (1 1 1) surfaces were investigated. There are two types of (1 1 0) and (1 1 1) surfaces, respectively named type A and type B. Among them, the surface of Co3O4(1 1 0) type B and (1 1 1) type B has ORR catalytic activity. (1 1 0) type B has two active sites on the surface, (1 1 1) type B has only one active site.
(2) According to the free energy diagram of ORR, the catalytic performance of (1 1 0) type B surface is better than (1 1 1) type B.
(3) The ORR reaction path on (1 1 0) type B surface was studied by using transition state search, the results show that Path(1) is the best ORR reaction path.
Keywords: oxygen reduction reaction, density functional theory, transition metal oxides
目录
第1章 绪论 1
1.1 燃料电池概述 1
1.1.1 燃料电池的简介及分类 1
1.1.2 燃料电池的结构和工作原理 2
1.2 氧还原反应机理 3
1.3 ORR催化剂的研究进展 4
1.3.1贵金属催化剂 5
1.3.2 过渡金属氧化物催化剂 6
1.4 电催化的理论模拟研究 6
1.4.1 溶剂效应 6
1.4.2 标准氢电极电势理论 7
第2章 理论基础和计算方法 9
2.1 量子化学简介 9
2.2 密度泛函理论简介 10
2.3 交换关联泛函 10
2.4 本论文所使用的软件 11
第3章 Co3O4(1 1 0)和(1 1 1)表面氧还原反应机理的密度泛函理论研究 12
3.1 引言 12
3.2 计算方法及模型 13
3.3 Co3O4表面结构及氧还原反应过程的吸附结构 13
3.3.1 Co3O4晶体的几何结构和电子态密度分析 13
3.3.2 Co3O4表面的几何结构和电子态密度分析 14
3.3.2 O2在Co3O4表面的吸附模型 18
3.3.3 氧还原反应中间体的吸附结构 20
3.3.4 基元反应步骤的反应自由能及自由能图 23
3.3.5 过渡态搜索确定ORR反应路径 26
第4章 结论 30
参考文献 31
致 谢 35
第1章 绪论
1.1 燃料电池概述
1.1.1 燃料电池的简介及分类
能源是整个世界发展和经济增长的最基本动力,也是人类生存的基础。根据国际能源署(IEA)在英国伦敦发布《世界能源展望2018》报告[1], 2013年全球能源需求达到18 TW,其中绝大多数(约80%)来自化石资源(煤炭,石油和天然气)。 随着世界人口的增长和工业化的不断扩大,全球能源需求预计将从2013年的18 TW增加到2040年的24或26 TW,相应的二氧化碳排放量从2013年的32 Gt /年增加到2040年的37或44 Gt /年。因此,人们对能源供应产生了重大关注,特别是与使用化石燃料相关的气候变化问题。所以,我们需要通过转向太阳能,风能和水力发电等可再生能源,使我们的能源多样化,减少对化石燃料的依赖。同时,新型能源技术的研究与发展也已成为当前非常紧迫的需求。
燃料电池是一种可直接将燃料的化学能转换成电能且无需经过卡诺循环的电化学能量转换装置。通常,氢气、甲醇、乙醇和天然气等碳氢化物可作为燃料电池的燃料[2],与传统的内燃机相比,燃料电池能够实现高效的化学-电力转换并减少温室气体的排放。根据燃料电池的反应温度,可将其分为五类,分别为:固态燃料电池(SOFC)的范围 800-1000℃、600-650℃范围为熔融碳酸盐燃料电池(MCFC)、磷酸燃料电池(PAFC) 在80-160℃范围、20-80℃范围内的质子膜燃料电池(PEMFC)和碱性燃料电池(AFC),不同种类的燃料电池具有不同的应用范围和技术限制,如图1-1所示[3]。其中,PEMFC是继AFC、PAFC、MCFC、SOFC之后正在迅速发展起来的第五代燃料电池,其启动温度最低(低于100℃)、比能量最高、启动时间最快、寿命最长等优势。因此,质子交换膜燃料电池在电动汽车领域[4]、无人机、家用电源以及移动电源和便携式电源方面具有重要的应用前景。
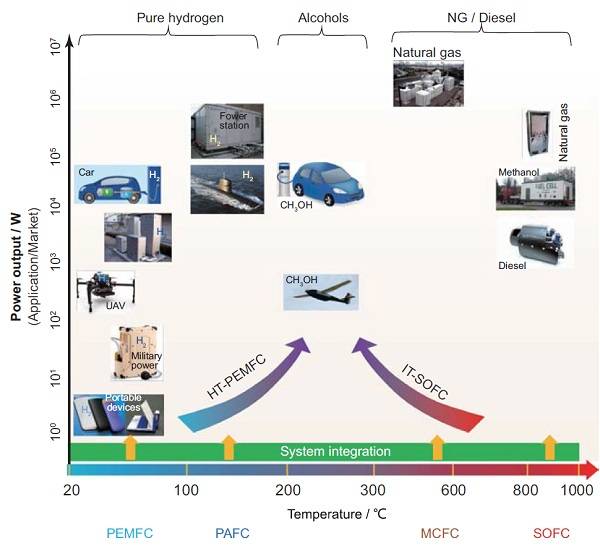
图1-1 燃料电池系统的商业应用
1.1.2 燃料电池的结构和工作原理
燃料电池主要由四个基本单元组成:电解质,阴极,阳极和电催化剂。燃料电池的阴极和阳极并不包含一般电池内部贮存的活性物质,只是作为催化转换元件,燃料电池运行时,燃料和氧化剂由外部供给。电解质常用来将阴极和阳极分离。因此,燃料电池是将化学能转化为电能的能量转换机器。
燃料电池的工作原理不同于一般电池。以质子交换膜燃料电池为例来介绍其原理[5]。质子交换膜燃料电池使用氢气和氧气作为燃料和氧化剂,以质子传导聚合物交换膜为电解质。如图1-2所示,在电池工作时,氢气会在阳极催化剂的催化作用下发生氧化反应,失去电子生成氢离子和自由电子,氢离子和自由电子分别通过交换膜和外电路到达阴极。接着在阴极催化剂的作用下,与氧气发生还原反应,生成产物水。
阳极反应: H2 → 2H 2e-
阴极反应: 1/2O2 2H 2e- → H2O
总 反 应: 1/2O2 H2 → H2O
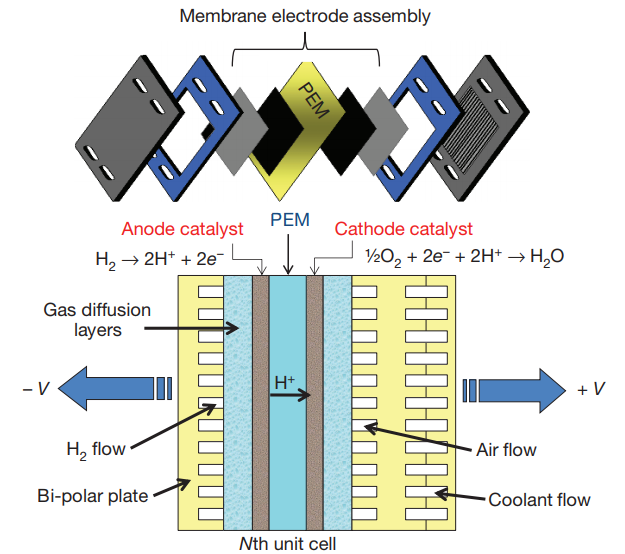
图1-2 PEMFC结构和工作原理图
1.2 氧还原反应机理
阴极缓慢的氧还原反应(Oxygen Reduction Reaction, ORR)是限制燃料电池(PEMFC)转换效率的主要因素,因此了解ORR的反应机制就显得尤为重要。氧还原反应过程涉及了多个反应步骤和电子转移过程,并且在酸性或碱性环境中的反应过程是不同的。目前被广泛认同的氧还原反应途径可以分为“二电子过程”和“四电子过程”[6-9]。二电子反应的部分氧还原产物过氧化氢会影响电极催化剂的催化效率,降低整个反应的速率和燃料电池的寿命,并且二电子过程有过氧化氢和HO2-两种中间产物生成,大大降低了燃料电池的能量输出效率。因此,为了提高燃料电池的工作效率,一般希望反应按照四电子的ORR过程进行。
对于酸性条件下的四电子ORR过程,氧气与氢结合生成水。首先氧气吸附在催化剂上,吸附后的O2与一个H 结合在表面形成 OOH*(*代表吸附位点),随后OOH*再结合一个H 并断开氧氧键,生成一个 H2O 脱离催化剂表面并留一个 O*中间体。然后O*再与H 结合形成中间物质OH*, 最后OH*再与一个H 结合又生成一个新的水分子,具体的反应方程式如下[10]:
四电子途径:
O2 * 4(H e-) →OOH* 3(H e-) (1-1)
OOH* 3(H e-) →O* H2O 2(H e-) (1-2)
O* H2O 2(H e-) →OH* (H e-) (1-3)
OH* H2O H e- → 2H2O (1-4)
总反应:O2 4(H e-) → 2H2O
二电子途径:
O2 2H 2e- → 2H2O2 (1-5)
H2O2 2H 2e- → 2H2O (1-6)
在碱性条件下的四电子ORR过程中,O2首先吸附在催化剂表面上并与水提供的质子形成OOH*,然后再结合一个电子并断开O-O键,生成的OH-脱离表面,剩下的一个O*在催化剂表面再与质子结合生成OH*,生成的OH*与一个电子结合生成OH-,具体反应过程如下所示[11]:
四电子途径:
O2 * 2H2O 4e- → OOH* OH- H2O 3e- (1-7)
OOH* OH- H2O 3e- → O* 2(OH-) H2O 2e- (1-8)
O* 2(OH-) H2O 2e-→ OH* 3(OH-) e- (1-9)
OH* 3(OH-) e- → 4(OH-) (1-10)
总反应:O2 2H2O 4e- → 4OH-
二电子途径:
O2 H2O 2e- → HO2- OH- (1-11)
HO2- H2O 2e- → 3OH- (1-12)
虽然我们希望氧还原反应过程是按照四电子反应路径进行的,但是实际的ORR过程是非常复杂的,往往是二电子和四电子反应路径并存。而且,在ORR过程中,氧气分子会转化为不同的中间体(OOH*、O*、OH*等),这些含氧中间体很难通过实验实际检测到。因此,研究ORR的反应路径具有很大的挑战性,但如果我们对ORR的基元反应和中间产物在催化剂表面的反应过程有更加清晰的认识,就可以帮助我们更加高效地鉴别ORR的速度控制步骤,从而指导研究者寻找更加有效的催化剂来提升燃料电池的工作效率。
1.3 ORR催化剂的研究进展
燃料电池发展至今,已经取得了许多重大的突破,但是其距离商业化仍然有许多路要走。首先,在燃料电池的电化学反应过程中,由于阴极的氧还原反应(ORR)势垒较高,导致其氧还原反应动力学速率要远低于阳极发生的氢气氧化反应,极大地限制了燃料电池的能量转化效率。而目前主要的阴极催化剂仍然是铂(Pt)基催化剂,由于铂金属的储量有限,价格昂贵,不可能长期满足商业化的需求。Pt基催化剂也存在着稳定性差和易中毒失活的问题[12-14]。其次,在燃料电池的燃料方面,目前认为比较好的燃料是氢气和甲醇,其中氢气的制备、运输和存储方面都具有较大的困难,仍然未得到有效地解决。目前最有可能进行商业化的甲醇燃料具有来源广,易于运输和存储的优点,然而,甲醇容易导致目前所用的铂基催化剂中毒而失去催化活性。
因此,要想让燃料电池尽早商业化,就需要寻找价格更加低廉,稳定性好,同时具有能够与铂电极材料催化性质相媲美甚至更好的催化剂材料。
目前,发展低铂基或者非铂基的ORR催化剂成为了当下主要的两种技术研究路线,并且已经取得了许多重要的研究成果和研究报道。下面,本文将从贵金属催化剂和非金属催化剂两个大类探讨目前ORR催化剂的研究进展。
1.3.1贵金属催化剂
Pt系贵金属由于其d轨道电子没有被完全占满,有利于产生较高的催化活性。同时,贵金属对高温、酸碱腐蚀和氧化等环境的耐受性要好于非贵金属,能表现出更好的ORR活性和稳定性。目前,贵金属氧还原催化剂的研究主要集中在Pt金属,以及其他的一些贵金属,比如钌(Ru)、铑(Rh)、钯(Pd)、金(Au)等。为了在降低Pt载量同时又能满足催化效率的要求,主要通过以下几种方法:(1)制备粒径在纳米级的贵金属颗粒,并选用合适的载体材料,提高Pt颗粒在载体上的比表面积、均匀性和分散度,暴露出更多的表面活性位点,从而提高催化效率。Zhuang Xu等[15]研究了Pt颗粒的尺寸对Pt/C催化剂的活性和耐久性的影响,发现随着Pt的粒径从3nm增大到6.5nm,Pt/C的表面活性和电化学稳定性均有所提高,进一步研究发现这是由于Pt颗粒尺寸的增加减少了表面和边界的原子,从而降低了Pt表面对含氧物(OH-)的吸附作用,进而暴露出更多的ORR活性位点,使得Pt表面的耐久性提高。此外,Tritsaris[16]和Wang Chao[17]等人也研究了Pt颗粒的尺寸和形貌等对电催化反应性能的影响,发现铂颗粒的粒径对Pt晶体表面的催化活性具有较大的影响;(2)在合成过程中加入其它金属元素形成铂合金催化剂,不仅可以降低Pt的使用量,而且还可以对铂合金的催化性能进行调控,进而获得较高的催化性能。许多研究者都对铂合金催化剂(PtM或PtMN,M,N= Pd、Fe、Co、Ni、Mn、Cu等)进行了广泛而深入的研究[18-22]。Li Jian等[23] 通过在纳米多孔Au上包覆一层亚纳米级Pt-Pd壳层,制备了一种新型纳米多孔电催化剂,该催化剂在0.9V下的ORR初始质量活性可达1.140 A ,是目前商用Pt/C催化剂的4~12倍。经过30,000个循环后,NPG-Pd-Pt的表面结构达到稳定,Pt质量活性增加到了1.471 A ,之后即使在70,000个循环周期以上也基本不变。Chong Lina等[24] 通过使用一种以Co或双金属Co和Zn沸石咪唑酯骨架为前驱体,制备了超低负载Pt含量、高活性、高稳定性的电催化剂的方法,利用Pt-Co核-壳纳米颗粒之间的协同催化作用,燃料电池在1个氧气或空气的大气压下,高压和高电流条件时都具有优异的催化性能。
上述方法在一定程度上能够满足燃料电池的ORR催化性能的要求,但是其铂载量并未达到能将燃料电池大规模商业化应用的要求。因此,新型非铂催化剂的研究与发展对燃料电池的商业化具有十分重要的意义。
1.3.2 过渡金属氧化物催化剂
贵金属催化剂(铂、钌、钯等)虽然具有较好的阴极氧还原反应催化性能,然而其资源有限,因此寻找更加廉价且高效的非贵金属催化剂具有重要意义。相对贵金属而言,过渡金属具有储量高、成本更加低廉以及更易于制备等优势。目前在ORR催化剂领域,过渡金属氧化物、碳化物、氮化物、氧氮化物以及硫族化合物等方向都有许多相关报道[25-27]。其中,氧化钴和氧化锰表现出了良好的ORR催化活性,成为研究热点。虽然目前其电催化性能还无法和铂基催化剂相比,但其具有良好的稳定性,而且结构易于调控,成本低廉,因此有很大的发展前景。
在过渡金属氧化物中,基于尖晶石型氧化物Co3O4的ORR催化剂一直吸引着众多学者进行研究。Co3O4的储量约为Pt的5000倍,在催化领域内有非常广泛的应用。许多研究表明,CO3O4纳米晶也是新型非Pt催化剂的潜在替代品。Deacute;bart等人[28]研究了几种催化剂的活性,并指出Co3O4的初始容量为2000 mAh∙g-1,每次循环容量保留率为6.5%。Y. Wang等人[29]制备的g-C3N4包裹的Co3O4纳米粒子负载在N掺杂的石墨烯上,显示出显着的ORR电催化性能,长期稳定性和更强的甲醇耐受性。
但Co3O4在燃料电池运行中,其活性和稳定性仍低于市售的Pt/C。为了提高Co3O4的ORR电催化性能,人们采用了多种方法,如晶面或形貌控制、尺寸控制、电导率增强和掺杂等。然而,据我们所知,仅由Co3O4晶面的变化引起的ORR电催化活性的影响尚未被报道。因此,研究Co3O4在ORR反应中的晶面效应,对于设计和制备含尖晶石氧化物的新型催化剂具有重要的指导意义。
1.4 电催化的理论模拟研究
1.4.1 溶剂效应
在实际的电催化反应中,溶剂对催化反应过程的电子转移和中间体的形成具有很大的影响。因此,我们在利用计算模拟来构建模型时有必要尽量考虑反应在溶剂中实际发生的情况,从而构建出更加合理的模型。目前,对于溶剂效应,备受关注的有两个方面:一是溶剂分子反应中心的短程作用(如配位键、氢键等),这种模型称为“真实溶剂模型”或者“微观溶剂模型”,这时溶剂化处理就需要采用确定的溶剂分子来考虑溶剂效应;另一个是溶剂分子的偶极矩与极性溶剂的偶极矩间的远程作用(静电相互作用),这时可以认为溶剂分子是分布在均一的连续介质中,从而来考虑这种远程作用的溶剂效应,这种模型称为连续介质模型。
根据以上介绍,在考虑溶剂效应时就有三种方法:(1)对于溶剂分子的短程作用很重要的体系,我们只考虑 “真实溶剂模型”,采用量子力学的方法,加入几个到几十个真实的溶剂分子,来模拟溶剂分子与反应中心的相互作用;(2)对于远程作用比较明显的体系,我们直接用连续介质模型来模拟这种远程作用,这时需要用一些物理模型来做近似处理,即用虚拟溶剂来模拟溶剂效应的影响,常见的连续介质模型有PCM、Onsager、COSMO、SMX等;(3)实际的催化反应体系往往需要综合考虑溶剂分子的短程作用和远程作用。因此,我们可以将“真实溶剂模型”和连续介质模型结合起来,模拟溶剂效应。这样既得到了分子力学的计算效率同时具有了量子力学的计算精度。
由于计算资源有限,且溶剂效应并不是本论文研究的重点,因此本论文中的计算模型没有考虑溶剂效应。
1.4.2 标准氢电极电势理论
我们在采用密度泛函理论(DFT)处理电化学体系时,往往需要一个固定电势的参比电极作为标准,目前国际上习惯采用标准氢电极(SHE)作为零电位的标准。标准氢电极的定义为,在氢离子活度为1mol/L的理想溶液中,由铂电极所构成的电极。基于此,Noslash;rskov等人[30,31]提出了计算氢电极(CHE)模型来解决电催化反应计算中所遇到的一些问题:(1)如何描述溶液中质子和电极上电子的能量();(2)如何估计液态水分子中氢键对总能的影响()。具体的解决方案描述如下:
对于问题(1),我们将标准氢电极作为参比电极,假设溶液中的质子和电极上的电子(H e-)与氢气处于平衡关系,如式(1-13)所示。
(1-13)
由于式子(1-13)的反应自由能Delta;G=0。定义电极电势U=0,以气相中的氢气作为参比,电子的化学势就改变了-eU,其中e代表基元电荷,U代表电压。因此,(H e-)的化学势之和与电压之间的关系如式子(1-14)所示:
(1-14)
根据吉布斯自由能公式(1-15):
(1-15)
S是体系的熵。当温度T=0K时,吉布斯自由能G与反应热H相等。同时,根据第一性原理,我们在计算时引入零点能(ZPE),H2的标准化学势可以定义为:
(1-16)




