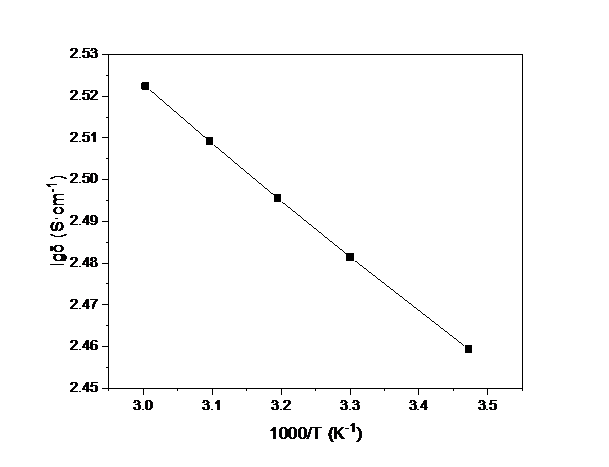LLZOP(MMA-VBIMBr)复合型固态电解质的合成与性能毕业论文
2020-02-13 11:55:49
摘 要
全固态锂离子电池由于其高的安全性而在能源领域有很好的应用前景,而固态电解质是全固态锂离子电池的关键部件。无机固态电解质与电极界面有较大的接触电阻,而聚合物固态电解质在常温下的离子电导率不高,而复合固态电解质可以解决这些问题。以甲基丙烯酸甲酯(MMA)和1-乙烯基-3-丁基溴化咪唑(VBIMBr)为单体,通过自由基溶液聚合得到了无规共聚物聚(甲基丙烯酸甲酯-1-乙烯基-3-丁基溴化咪唑)[P(MMA-VBIMBr)]。以此聚合物为基底,将使用溶胶凝胶法制备的立方相Li7La3Zr2O12(LLZO)粉末与锂盐LiTSFI分散于其中制得了LLZO/P(MMA-VBIMBr)复合型固态电解质。使用了X射线衍射、傅里叶变换红外光谱、扫描电子显微镜、综合热分析(TG/DSC)以及电化学交流阻抗等表征手段对其性质进行了研究。结果表明这种复合型固态电解质在LLZO与[P(MMA-VBIMBr)]的质量比为1∶2%时性能最佳,在30℃下具有6.34times;10-3S·cm-1的离子电导率,而且其离子电导率随温度升高而增大,基本符合阿伦尼乌斯方程。
关键词:离子液体;固态电解质;离子电导率;氧化物快锂离子导体;全固态锂离子电池
Abstract
All-solid-state lithium batteries have great prospect in the field of power sources due to their benefit in safety. Solid-state electrolytes are the critical component of all-solid-state lithium batteries. The interface resistance between electrodes and inorganic solid-state electrolytes is an obstacle. The ionic conductivities of polymer electrolytes are relatively lower. Composite solid-state electrolytes are considered to be the solution to these problems. A random co-polymer poly-methyl methacrylate-1-vinyl-3-butylimidazodium bromide [P(MMA-VBIMBr)] was synthesized via radical solution co-polymerization with methyl methacrylate (MMA) and 1-vinyl-3-butylimidazodium bromide (VBIMBr) as monomers. This polymer was used as matrix, in which the cubic phase Li7La3Zr2O12(LLZO)powder synthesized by sol-gel process and lithium salt LiTSFI were dispersed, forming the LLZO/P(MMA-VBIMBr) composite solid-state electrolyte. Performances and properties of it were studied by X-ray diffraction, Fourier transform infrared spectroscopy, scanning electron microscope, comprehensive thermal analysis (TG/DSC) and electrochemical alternating-current impedance technique. The results showed that this composite electrolyte had the best performance when the mass ratio of LLZO to P(MMA-VBIMBr) was 1∶2%. The ionic conductivity was 6.34times;10-3S·cm-1 at 30℃, which growed higher with the increasing temperature. The dependence of ionic conductivity on the reciprocal of temperature for the composite electrolyte appeared to obey Arrhenius equation.
Key words: ionic liquid; soild-state electrolyte; ionic conductivity; oxide lithium fast ionic conductor
目 录
第1章 绪论hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;...1
1.1 锂离子电池的发展方向hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;..1
1.2 固态电解质概述hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;..2
1.2.1 氧化物固态电解质hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;...2
1.2.2 硫化物固态电解质hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;...3
1.2.3 聚合物固态电解质hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;...4
1.2.4 固态电解质的制备方法hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;...4
1.3 实验路线的选择hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;..5
第2章 LLZO/P(MMA-VBIMBr)复合电解质的制备与测试hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;.8
2.1 试剂与仪器hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;..8
2.2 无机固态电解质LLZO的合成hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;..9
2.3 聚合物电解质P(MMA-VBIMBr)的合成hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;.10
2.3.1 离子液体1-乙烯基-3-丁基溴化咪唑(VBIMBr)的合成hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;..10
2.3.2 聚(甲基丙烯酸甲酯-1-乙烯基-3-丁基溴化咪唑)[P(MMA-VBIMBr)]的合成hellip;10
2.4 复合电解质的制备hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;10
2.5 复合电解质离子电导率的测定hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;11
第3章 结果与讨论hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;.12
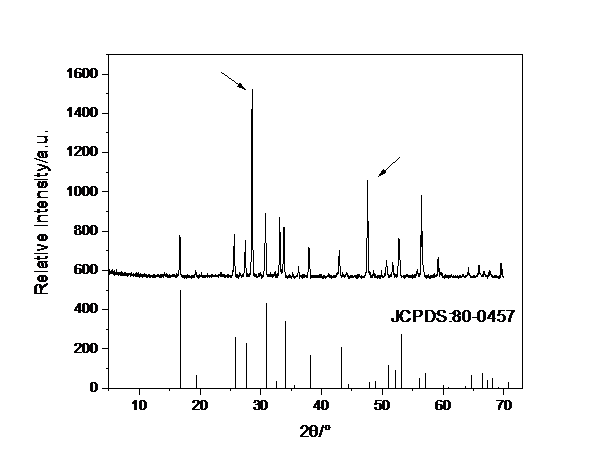
3.1 LLZO的XRD分析hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;...12
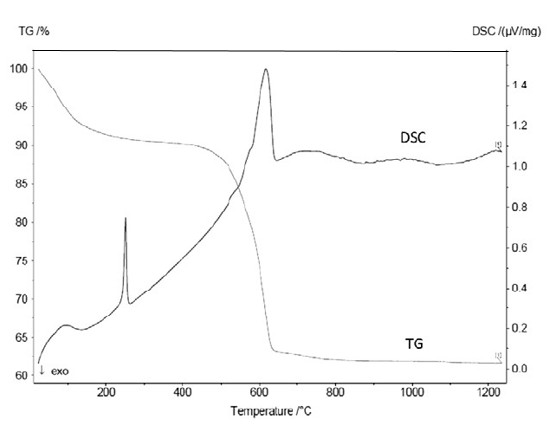
3.2 LLZO溶胶-凝胶的TG/DSC分析hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;13
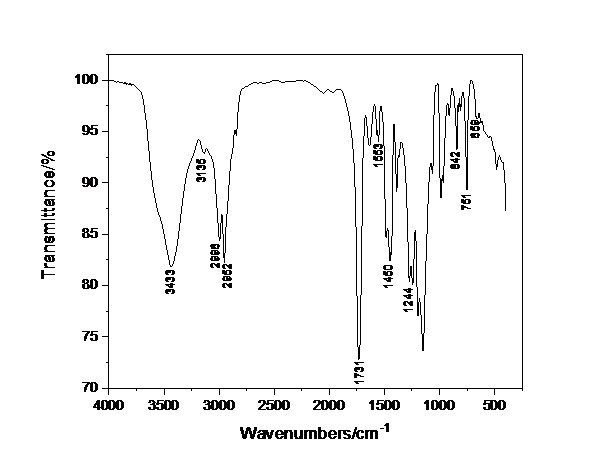
3.3 P(MMA-VBIMBr)的红外光谱分析hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;...14
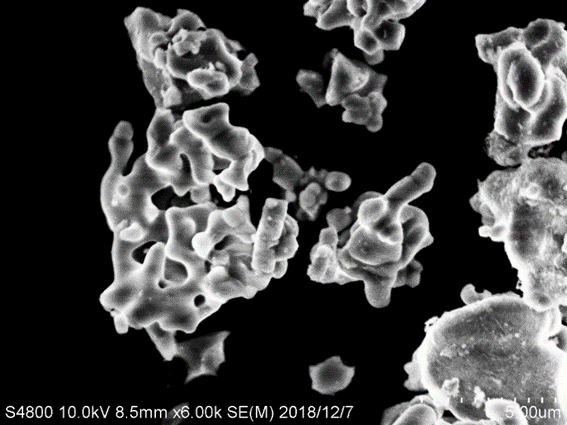
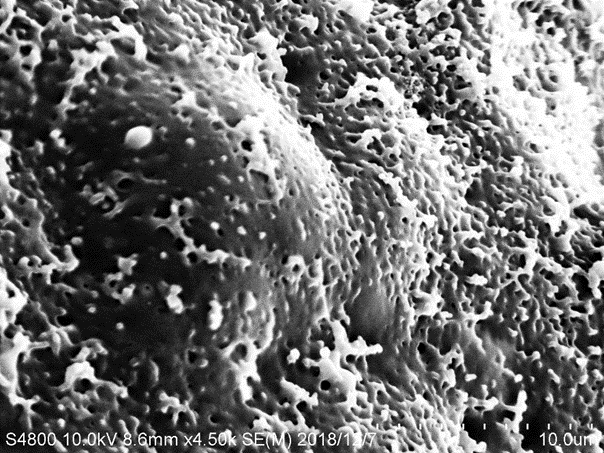
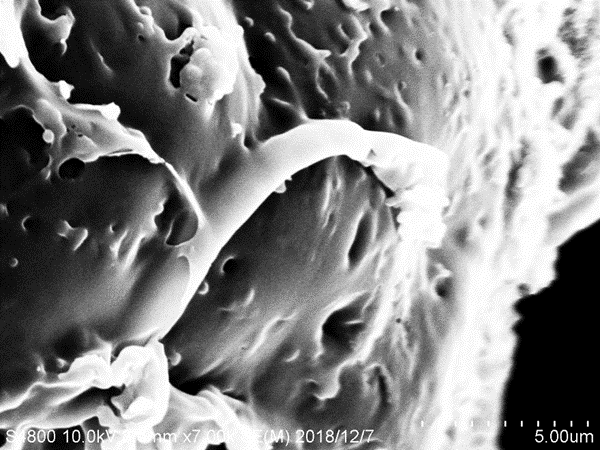
3.4 LLZO和P(MMA-VBIMBr)的微观形貌分析hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;15
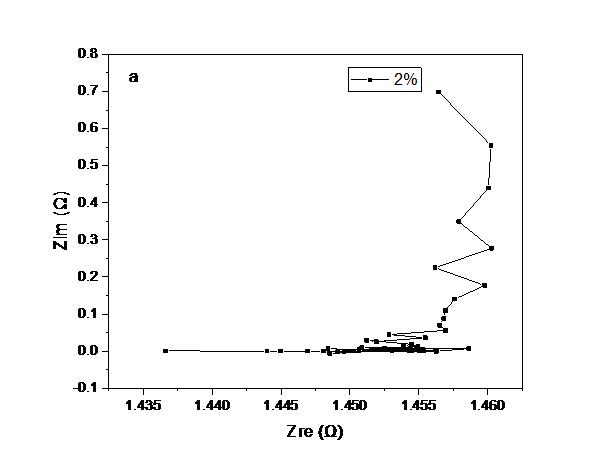
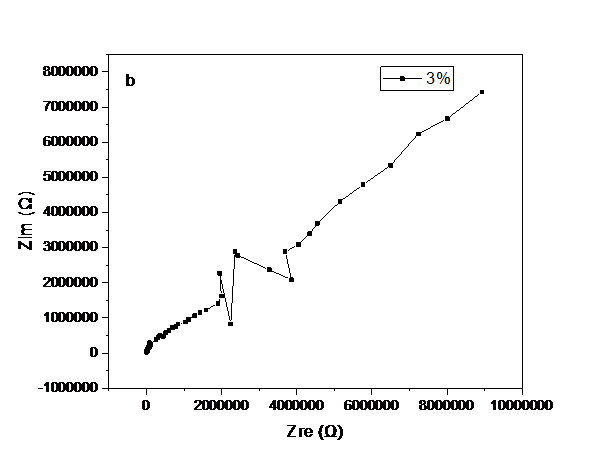
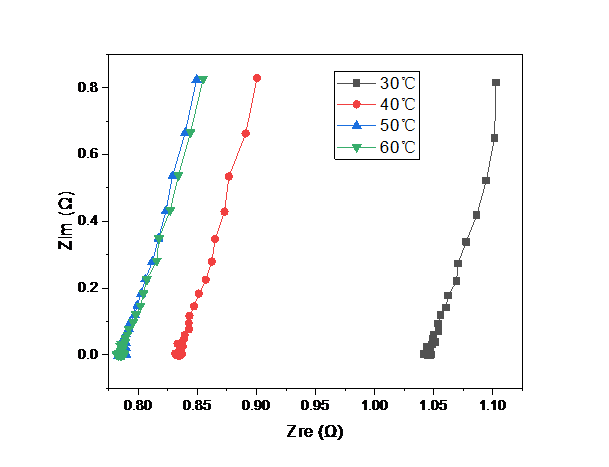
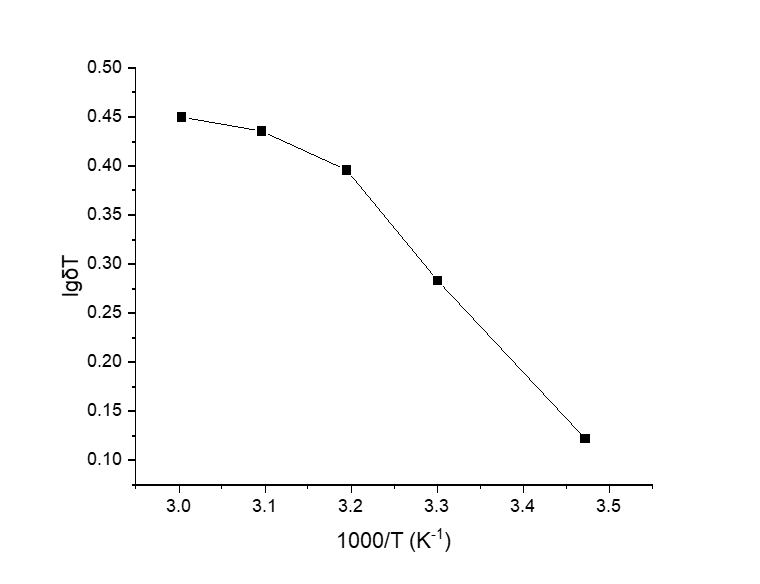
3.5 LLZO/P(MMA-VBIMBr)复合电解质的离子电导率测试hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;16
3.6测试结果与其他类型复合固态电解质的比较hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;..19
第4章 结论hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;..21
参考文献hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;...22
致谢hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;hellip;...23
第1章 绪论
1.1 锂离子电池的发展方向
锂离子电池自从被商业化以来便在电池市场中占据重要位置。由于其具有能量密度高、输出功率大、电压高、自放电小、无记忆效应和环境友好等优点,已广泛应用于电动汽车、便携电子设备、轨道交通、大规模储能和航空航天等领域。锂离子电池主要有正极,负极,电解质,隔膜组成,要获得有良好性能的锂离子电池体系,电池中各个部分都至关重要,而电解质是其中不可缺少且极其关键的一部分,是作为离子转运途径的关键组分之一。锂离子电池的电池容量,工作温度范围,安全问题和可再充电性均受到所选电解质体系的影响。根据其物理状态,电解质可分为液体电解质和固体电解质。
目前常见的锂离子电池使用的是有机体系的液体电解质。这种液态电解质一般是将锂盐(比如LiPF6)溶于链状和环状的烷基碳酸酯的混合溶剂中制成,拥有充放电速率高以及离子电导率高的优势。但在过充或者短路情况下电池的温度容易升高。电池的温度升高会加剧电解液与电极之间的反应,从而产生更多的热量和气体,易燃的有机电解液接触到氧气,在高温下容易着火甚至爆炸。
除了易燃易爆之外,有机液态电解液在长期使用过程中可能会出现挥发,泄露,使电池容量发生不可逆的衰减。液态电解液在低温下容易转化为固体,电池内阻增大,低温下的离子电导率明显下降,严重影响电池性能,因此传统锂离子电池的工作温区较窄。
传统锂离子电池无法使用高能量密度的金属锂作为负极材料,因为在电池循环过程中,由于金属锂表面电流密度及锂离子分布不均匀等因素,锂电极容易反复溶解、沉积,形成不均匀的孔洞和枝晶。枝晶有可能刺穿隔膜,到达电池正极,造成电池短路的安全隐患[1]。
为了解决锂电池存在的一系列缺点,其今后的发展方向便是使用固态电解质替代有机液态电解质,制得全固态锂离子电池,它具备以下显著的优点:第一,固态电解质一般不易挥发,也不易燃,因此全固态锂离子电池更加安全;第二,固态电解质可以在比较宽的温度范围以内保持稳定,离子电导率随着温度的变化不大,所以全固态锂离子电池的工作温区相对较宽;第三,固态电解质的电化学稳定性比较好,具有较宽的电化学窗口,使高电压电极材料以及锂金属负极有望得以应用,从而有利于提高电池的能量密度;第四,由于全固态锂离子电池出色的安全性能,在将其组装成大型储能模块时并不需要额外配置电池管理系统等附件,结构简单,体积更小[2]。正因为具备以上优点,固态电解质近年来成为了能源领域的研究焦点。
1.2 固态电解质概述
针对全固态锂离子电池的核心部件,固态电解质,近年来各国学者进行了广泛的研究。具有实用性的固态电解质应达到离子电导率高,离子迁移数高,电化学性能及热稳定性良好,有一定机械强度,与电极兼容性好等条件。
根据材料种类,固态电解质可大致分为氧化物型,硫化物型和聚合物型。
1.2.1 氧化物固态电解质
被研究得较多的氧化物固态电解质有NASICON型、LISICON型、钙钛矿型、反钙钛矿型和石榴石型。
NASICON型固态电解质的结构通式为LiM2(PO4)3,其中M为Ti、Ge、Zr等金属离子。其晶体结构为MO6八面体与PO4四面体通过共顶角相连形成刚性骨架,锂离子在三维隧道中迁移。其目前主要有Li2O-Al2O3-TiO2-P2O5(LATP)和Li2O-Al2O3-GeO2-P2O5(LAGP)两个体系。使用Al、Ga、Cr等三价离子对其进行掺杂能提高其电导率。其电导率在室温下可达到10-3S·cm-1,但是体系中的Ti4 在与金属锂接触的过程中易被还原成Ti3 ,使电解质材料不稳定。
LISICON型固态电解质由Zn2 、Sn4 等异价离子取代Li4GeO4或Li4SiO4制得,如Li4 2xZnxSi1-xO4。其室温电导率较低,仅有10-5S·cm-1左右,这是因为其刚性的亚晶格在较低温度下会通过形成缔合缺陷的形式捕获可迁移的锂离子,在低温下其离子电导率还会随应用时间的增加而继续降低,但在退火后其电导率会恢复。利用此特性,LISICON型固态电解质可被用于制造低温下储存,通过升温操作热激活的功能电池[3]。
Li3xLa2/3-xTiO3(LLTO)是目前被研究得最多的钙钛矿型固态电解质,其钙钛矿结构(ABO3)中的A位点被Li或La部分占据,锂离子通过临近的A空位传输,因此离子电导率与A空位浓度、掺杂离子密切相关[4]。LLTO具有结构稳定,成分可变范围大,电化学窗口宽等优势,颗粒室温电导率可达10-3S·cm-1,但其晶界阻抗较大,导致总电导率减少,因此晶界修饰对提高其性能很重要。
反钙钛矿型固态电解质可表示为Li3-2xMxOX,其中M为Ca、Mg、Ba等金属离子,X为卤素Cl、Br或I离子。其晶胞结构为卤素离子占据顶角,氧离子位于体心,锂离子或取代的M离子占据面心。掺杂的2价金属离子使得晶格中产生大量空位,它们可供锂离子传输并降低其扩散活化能。据报道掺杂Ba的反钙钛矿型固态电解质的室温电导率高达2.5times;10-2S·cm-1。
石榴石型固态电解质的结构通式为Li3 xA3B2O12,AO8十二面体和BO6八面体通过共棱连接交错构成骨架。当x为0时锂离子被严格束缚在四面体空位中。当x大于0时,锂离子逐渐占据束缚较弱的八面体空位,四面体空位出现空缺,离子电导率上升。Li7La3Zr2O12(LLZO)是被研究最多,性能较好的一种石榴石型固态电解质,具有立方相和四方相两种骨架结构相同的相,其中立方相是高温稳定相。立方相LLZO的室温离子电导率比四方相的高2个数量级,可达10-4S·cm-1。研究显示,由于四方相中锂离子呈高度有序化排布,锂离子的迁移表现出多个离子同步迁移的特性,离子迁移困难;立方相中锂离子位置被部分占据,晶体中存在着大量随机分布的锂离子空位,锂离子表现出单个跃迁特性,迁移激活能较低[5]。此外,LLZO的带隙较宽,在空气中很稳定,机械强度优良,被认为是具有很好前景的固态电解质材料。
1.2.2 硫化物固态电解质
与氧离子相比,硫离子的离子半径更大,可以构成更大的锂离子传输通道;硫的电负性比氧低,弱化了锂离子与相邻骨架结构间的键合作用,提高了自由锂离子浓度;许多主族元素与硫能够形成更强的共价键,得到的硫化物不易与锂电极反应。因此硫化物固态电解质的离子电导率普遍比氧化物固态电解质大。被研究得较多的硫化物固态电解质有Thio-LISICON型和LGPS。
Thio-LISICON型固态电解质是将LISICON型固态电解质中的氧离子替换为硫离子得到的,通式为LixM1-yNyS4,其中M为Si或Ge,N为P、Al、Zn、Ga或Sb。相比氧化物固态电解质,其具有较好的延展性,以及较低的晶界电阻。硫离子的高度极化使得锂离子与阴离子亚晶格之间的作用减弱,离子电导率得以增强,室温电导率约为10-3S·cm-1。
硫化物Li10GeP2S12(LGPS)在室温下表现出了高达1.2times;10-2S·cm-1的电导率。其三维网状结构由LiS4四面体,LiS6六面体,PS4四面体和(Ge/P)S4四面体组成,c轴方向的锂离子传输通道由共棱的LiS4四面体链提供。结构的高度对称及大量的空位导致其结构不太稳固。虽然LGPS电导率颇高,不过电化学窗口有限,且与锂金属的界面稳定性不好。
值得注意的是硫化物对水分敏感,在空气中会缓慢生成H2S气体,并且材料的热稳定性比较差,限制了其应用[6]。
1.2.3 聚合物固态电解质
聚合物固态电解质通常是由极性高分子和金属盐络合而成,与液态电解质和无机固态电解质相比,具有诸多优势,如在充电和放电过程中对电极体积变化的耐受性增加,具有高的安全性,良好的可加工性、力学柔性、黏弹性,且易成膜。被研究得较多的聚合物固态电解质有聚环氧乙烷基,聚硅氧烷基,聚碳酸酯基及聚丙烯腈基。
聚环氧乙烷(PEO)基聚合物电解质是最早发现的一类聚合物固态电解质,其导电过程主要是锂离子与PEO链上的醚氧基发生络合-解络合,通过PEO的链段运动实现锂离子的迁移。纯PEO的室温离子电导率只有10-7S·cm-1左右,原因主要是PEO的结晶度高,限制了链段的局部松弛运动,进而阻碍了锂离子的快速迁移[7]。为了提高电导率,学者们在研究使用共聚,掺杂等手段抑制聚合物结晶。
聚硅氧烷中的硅氧键有较小的旋转势能,因此分子链柔软,链段运动能力强,易形成无定型结构,能获得较低的玻璃化转变温度,但其本身没有极性,无法解离锂盐。因此聚聚硅氧烷通常与其他聚合物链段聚合以改善其离子电导率,室温下可达10-5S·cm-1左右。
聚碳酸酯中有强极性的碳酸酯基团,有利于锂盐解离,提高自由锂离子浓度,进而提高离子电导率和离子迁移数。聚碳酸酯基聚合物电解质包括聚碳酸乙烯酯(PEC)、聚碳酸丙烯酯(PPC)、聚三亚甲基碳酸酯(PTMC)和聚碳酸亚乙烯酯(PVC)几种类型,室温电导率为10-4S·cm-1左右。
聚丙烯腈中的氰基极性强,具有孤电子对,易与锂盐和离子液体中的极性基团作用。聚丙烯腈基聚合物电解质有较高的热稳定性,机械强度,电化学稳定性,室温电导率可达10-4S·cm-1 [8]。
1.2.4 固态电解质的制备方法
总的来说有以下几种合成固态电解质的策略:高温固相反应,溶胶凝胶法,场辅助烧结和薄膜沉积。
高温固相反应是制备晶态固态电解质的常用方法。固相反应一般由相界面上的化学反应和固相内的物质迁移两个过程构成,需要将反应物研磨成颗粒极细的粉体,均匀混合后在1000至1500℃的高温下反应。高温固相反应合成的优势是产量大,制备工艺简单,缺点也显而易见,如能耗高,效率低,反应容器污染产物,产物的组成不均匀,粒径的分布范围宽等。
溶胶凝胶法是新兴的实用制备方法,具体过程是将金属醇盐等前驱体溶于水或有机溶剂中配成均质溶液,在一定温度下发生水解或醇解反应形成溶胶,溶胶陈化形成凝胶,再经过干燥、烧结得到产物。溶胶凝胶法的优点是反应物混合充分均匀,产物的组成可以精确调控,得到的晶粒尺寸小,所需的烧结温度相对于固相反应法比较低。其缺点是原料成本比较高,制备过程复杂,周期较长。
场辅助烧结(FAST)是一种新型快速烧结技术。将原料粉末装入石墨等材质的模具中,在加热加压的同时导入脉冲电流,利用原料粉体表面的电火花放电去除表面的杂质并使表面活化,促进烧结,使烧结所需的温度与时间降低。场辅助烧结一般只需10分钟左右,可以有效避免由于烧结温度过高和烧结时间过长引起的锂元素的损失。同时该技术可以在烧结过程中对粉体施加单轴的压力,有效提高产物的致密度。
在制备如锂磷氮氧(LiPON)等薄膜固态电解质时,可用磁控溅射、化学气相沉积(CVD)和原子层沉积(ALD)等薄膜沉积技术。LiPON最开始是以LiPO4为靶材,在N2气氛下通过磁控溅射制得,对锂金属电极的稳定性较好,室温电导率为10-6S·cm-1左右[9]。但这样制备LiPON存在生长速率较低,薄膜易开裂的问题。因此人们换用金属-有机物化学气相沉积法制备LiPON,然而CVD制得的LiPON的离子电导率对沉积过程中基底的温度十分敏感。最近,原子层沉积技术被用于制备LiPON,其特点是可以将单原子膜一层层镀在基底上,与普通的CVD相比,新一层的原子膜发生的化学反应是与前一层相联系的,因此可以实现出色的均匀性,极高的保形性和原子级的光滑度。
1.3 实验路线的选择
对比几种固态电解质类型,无机固态电解质的室温离子电导率更高,但其与电极之间固-固界面接触不好,易造成较大的界面电阻;聚合物固态电解质的室温离子电导率较低,但与电极的接触更好,界面反应较少,在充放电过程中对电极体积变化的耐受性更好,可加工性更好。因此,将无机与聚合物固态电解质进行复合,可以使两者的优势互补,获得性能优异的产品。
我最终选用的无机固态电解质是立方相Li7La3Zr2O12,该材料具有较高的离子导电率(最高为4times;10-4S·cm-1)、优良的稳定性和电化学性能,与金属锂接触稳定,电化学窗口高达6 V,扩大了正负极材料的选择范围。综合对比其他无机固态电解质,LLZO的优势较多。LLZO的传统制备方法是高温固相反应,但高温固相反应的反应效率低,能耗高,对加热仪器的条件苛刻,遂选用反应条件较为温和的溶胶凝胶法制备。实验证明用Li、La的醋酸盐及Zr的醇盐,通过溶胶凝胶法制得的LLZO与用高温固相反应制得的LLZO同样拥有较高的离子电导率(1.5times;10-4S·cm-1)[10]。
至于聚合物基体,我选用甲基丙烯酸甲酯(MMA)与离子液体进行共聚。PMMA中的碳氧键上的氧原子可提供孤对电子,能与无机盐中的阳离子配位,提供离子传导。但PMMA的机械强度不够,可以选用系统的化学或物理方法,如共混,共聚和交联提高电解质的机械强度以及传输性能和电化学性能。
共混是指将两种或两种以上的聚合物进行物理混合。用来共混的两聚合物中,其中一聚合物分子链排列规整,易形成晶体结构,不宜于锂离子的传导,但能其力学骨架支撑的作用,而另一种聚合物会破坏大部分的规整分子链排列,使整个聚合物体系成无定形态聚合物,获得非晶结构,提高离子电导率。与其他方法相比,共混能够通过调节两种聚合物的比率来控制整个聚合物体系的材料性能。但是这种共混聚合物电解质存在一个缺点,即因两聚合物之间极性的不同,会使整个电解质体系出现相分离,电解质体系不均一。
共聚与共混类似,以一种规整聚合物为单体,提供力学骨架,另一种单体加入破坏其规整性,不过两种聚合物单体之间是通过化学反应共聚在一起。形成的共聚物种类包括无规共聚物,嵌段共聚物,梳形共聚物等,是制备电解质基体材料中最有实用意义的,应用最多的方法。
交联是指聚合物的支链之间通过共价键联结,形成三维网状结构。交联手段包括化学交联,辐射交联等。化学交联是指用紫外光照射用引发剂引发单体聚合直接形成聚合物电解质。辐射交联法是指在单体聚合成聚合物之后,再在交联剂作用下形成交联网络聚合物,在无引发剂,无化学残留的情况下发生链交联,获得既有较多离子传输通道,又有良好力学性能的聚合物电解质。
我最终选用有一定离子电导率的离子液体与其共聚,对PMMA基体进行改性[11]。离子液体(IL)又被称为室温熔融盐,一般由大体积的有机阳离子和阴离子组成。离子液体的特性为具有较高的热稳定性,电化学稳定性,疏水性,低挥发性,强溶解性,宽液态范围,宽电化学窗口,结构性质可控[12]。离子液体可用于气体的吸附和分离,代替传统有机溶剂进行分离提纯,作化学反应溶剂,催化剂,或作电解质。根据其组成离子的化学结构,离子液体被归类为几个亚类,包括质子性离子液体,非质子性离子液体和溶剂化物(螯合)离子液体。质子离子液体(PIL)由离子组成活性(反应性)质子(主要在阳离子结构中),并且容易通过布朗斯特酸,碱之间的反应来制备。由非质子离子组成的离子液体被称为非质子离子液体(APIL)。典型的非质子离子液体由分别具有低路易斯酸性和碱性的阳离子/阴离子组合组成。它们的热稳定性比质子离子液体更好,其某些阳离子/阴离子组合与水不混溶。这些引人入胜的液体材料由于其可控的物理化学性质,能对阳离子/阴离子组合进行结构选择而被称为“可设计溶剂”。我选用常用的离子液体1-乙烯基-3-丁基溴化咪唑(VBIMBr)与MMA进行共聚。
聚合物电解质体系需要锂盐提供锂离子。锂盐根据阴离子的不同主要分为两类,一是无机阴离子型,如LiPF6、LiAsF6、LiBF4和 LiClO4,另一类是有机阴离子型,如:LiCF3SO3(LiTF)、LiN(CF3SO2)2(LiTFSI)和 LiC(CF3SO2)3。LiPF6的导电性最好,但在使用过程中会有HF气体产生,HF对人体有害且会腐蚀电池内部。LiAsF6中的砷元素也对人体有害。LiBF4易在电极表面产生钝化膜,导致电解质连续降解,锂损失增加,电池阻抗增加。LiTFSI是一种比较特殊的有机锂盐,它本身含有一个吸电子基团,即TFSI-阴离子,TFSI-中的氮,硫,氧三种原子使整个TFSI-阴离子形成大pi;键共轭体系,整个共轭体系中电荷均匀分布。此外,整个共轭体系中含有的氧原子的强吸电子作用使电子云偏离氮原子,导致整个共轭体系与锂离子的结合力弱,游离锂离子多,锂离子迁移更易进行,离子电导率得到提高。正因为 LiTFSI 的特殊结构所具有的优势,使其成为锂离子电池中应用最广的有机锂盐,我也选用LiTFSI为体系提供锂离子。
第2章 LLZO/P(MMA-VBIMBr)复合电解质的制备与测试
2.1 试剂与仪器
在本文实验中用到的试剂及其纯度、生产厂家等见表2.1。制备用到的主要实验仪器及其型号见表2.2。表征用到的仪器及其型号、生产厂家见表2.3。
以上是毕业论文大纲或资料介绍,该课题完整毕业论文、开题报告、任务书、程序设计、图纸设计等资料请添加微信获取,微信号:bysjorg。
相关图片展示: